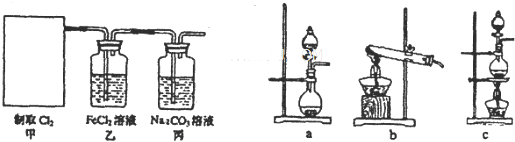
��Ŀ����
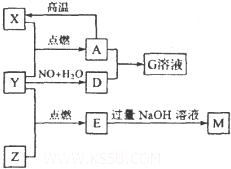 ���ֳ�������֮�������ͼת����ϵ������X��Y��ZΪ���ʣ��������ʾ�Ϊ���� ���֪YΪ��ɫ��ζ���壬EΪ��ɫ�д̼�����ζ���壬��ʹƷ����Һ��ɫ��G��Һ�ʻ�ɫ������֮�䣨���ֲ��P������ȥ������ش��������⣺
���ֳ�������֮�������ͼת����ϵ������X��Y��ZΪ���ʣ��������ʾ�Ϊ���� ���֪YΪ��ɫ��ζ���壬EΪ��ɫ�д̼�����ζ���壬��ʹƷ����Һ��ɫ��G��Һ�ʻ�ɫ������֮�䣨���ֲ��P������ȥ������ش��������⣺��1������AΪ
���ѧʽ��
��2�����������в���ʵ��A-Xת������
a��һ����̼ b������ c��ľ̿
��3��д����ӦE��M�����ӷ���ʽ
��4������G��Һ���������������ӵķ�����
��5����2molD��ϡ��Һ�У�����һ������X��ĩ������D��ȫ��Ӧ�����ɵ�����ֻ��һ�֣���Ӧ��X�����ʵ�����ΧΪ
���㣺������ƶ�
ר�⣺�ƶ���
������X��Y��ZΪ���ʣ�����Ϊ�����EΪ��ɫ�д̼�����ζ���壬��ʹƷ����Һ��ɫ����EΪSO2��G��Һ�ʻ�ɫ�����������ӣ���A�к���FeԪ�أ�X������Y�ڵ�ȼ����������A����XΪFe����AΪFe3O4��YΪO2��DΪHNO3��GΪFe��NO3��3�����ת����ϵ��֪��ZΪS��MΪNa2SO3���ݴ˽��
���
�⣺X��Y��ZΪ���ʣ�����Ϊ�����EΪ��ɫ�д̼�����ζ���壬��ʹƷ����Һ��ɫ����EΪSO2��G��Һ�ʻ�ɫ�����������ӣ���A�к���FeԪ�أ�X������Y�ڵ�ȼ����������A����XΪFe����AΪFe3O4��YΪO2��DΪHNO3��GΪFe��NO3��3�����ת����ϵ��֪��ZΪS��MΪNa2SO3��
��1��������������֪������AΪFe3O4��DΪHNO3���ʴ�Ϊ��Fe3O4��HNO3��
��2��A-Xת��������������ת��ΪFe��������ԭ��Ӧ��������CO��ľ̿��Ӧʵ�֣���ѡ��b��
��3����ӦE��M�����ӷ���ʽΪ��SO2+2OH-�TSO32-+H2O���ʴ�Ϊ��SO2+2OH-�TSO32-+H2O��
��4��GΪFe��NO3��3������Һ����������������ΪFe3+������Fe3+�ķ����ǣ�ȡG��Һ�������Թ��У������еμ�KSCN��Һ����Һ��ɺ�ɫ����֤��G��Һ����Fe3+���ڣ���ȡG��Һ�������Թ��У������еμ�NaOH��Һ���к��ɫ������������֤��G��Һ����Fe3+���ڣ�
�ʴ�Ϊ��ȡG��Һ�������Թ��У������еμ�KSCN��Һ����Һ��ɺ�ɫ����֤��G��Һ����Fe3+���ڣ���ȡG��Һ�������Թ��У������еμ�NaOH��Һ���к��ɫ������������֤��G��Һ����Fe3+���ڣ�
��5����2mol HNO3��ϡ��Һ�У�����Fe��ĩ���ɵ�����ֻ��һ��ΪNO����������������ʱ���ܽ�Fe�����ʵ����������Fe2+Ϊxmol�����ݵ���ת���غ㣬��n��NO��=
=
x mol�����ݵ�ԭ���غ��֪2n[Fe��NO3��2]+n��NO��=n��HNO3������2x mol+
x mol=2mol�����x=0.75��
������������ʱ���ܽ�Fe�����ʵ�����С������Fe3+Ϊymol�����ݵ���ת���غ㣬��n��NO��=
=y mol�����ݵ�ԭ���غ��֪3n[Fe��NO3��3]+n��NO��=n��HNO3������3y mol+y mol=2mol�����y=0.5��
�ʷ�Ӧ��Fe�����ʵ�����ΧΪ��0.5mol��n��Fe����0.75mol��
�ʴ�Ϊ��0.5��0.75��
��1��������������֪������AΪFe3O4��DΪHNO3���ʴ�Ϊ��Fe3O4��HNO3��
��2��A-Xת��������������ת��ΪFe��������ԭ��Ӧ��������CO��ľ̿��Ӧʵ�֣���ѡ��b��
��3����ӦE��M�����ӷ���ʽΪ��SO2+2OH-�TSO32-+H2O���ʴ�Ϊ��SO2+2OH-�TSO32-+H2O��
��4��GΪFe��NO3��3������Һ����������������ΪFe3+������Fe3+�ķ����ǣ�ȡG��Һ�������Թ��У������еμ�KSCN��Һ����Һ��ɺ�ɫ����֤��G��Һ����Fe3+���ڣ���ȡG��Һ�������Թ��У������еμ�NaOH��Һ���к��ɫ������������֤��G��Һ����Fe3+���ڣ�
�ʴ�Ϊ��ȡG��Һ�������Թ��У������еμ�KSCN��Һ����Һ��ɺ�ɫ����֤��G��Һ����Fe3+���ڣ���ȡG��Һ�������Թ��У������еμ�NaOH��Һ���к��ɫ������������֤��G��Һ����Fe3+���ڣ�
��5����2mol HNO3��ϡ��Һ�У�����Fe��ĩ���ɵ�����ֻ��һ��ΪNO����������������ʱ���ܽ�Fe�����ʵ����������Fe2+Ϊxmol�����ݵ���ת���غ㣬��n��NO��=
| 2xmol |
| 5-2 |
| 2 |
| 3 |
| 2 |
| 3 |
������������ʱ���ܽ�Fe�����ʵ�����С������Fe3+Ϊymol�����ݵ���ת���غ㣬��n��NO��=
| 3ymol |
| 5-2 |
�ʷ�Ӧ��Fe�����ʵ�����ΧΪ��0.5mol��n��Fe����0.75mol��
�ʴ�Ϊ��0.5��0.75��
���������⿼�������ƶϡ�������ԭ��Ӧ����ȣ��Ѷ��еȣ�G��Һ��ɫ��E���������ƶϵ�ͻ�ƿڣ��ٽ��ת����ϵ�������Ʒ������Ʒ������ƶϣ���3��ע�����ü������غ㷨���м��㣮

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
ij�л���ȼ�պ����ֻ��CO2��H2O�����Ƴ��Ľ����������л����У�������
| A��һ��ֻ��C��H��O |
| B�����ܺ���C��H��O |
| C��һ������C��H����O |
| D��һ������C��H��������O |
���ֶ�����Ԫ�ص�ԭ�Ӱ뾶����Ҫ���ϼۼ��±������ݱ�����Ϣ���ж�����˵����ȷ���ǣ�������
| Ԫ�ط��� | X | Y | Z | M | N |
| ԭ�Ӱ뾶��nm�� | 0.160 | 0.111 | 0.104 | 0.143 | 0.066 |
| ��Ҫ���ϼ� | +2 | +2 | -2��+4��+6 | +3 | -2 |
| A��������ϡ���ᷴӦ�����ʿ�����M��Y��X |
| B��Ԫ��Z��N�����������6 |
| C��Ԫ��Y��Z����ͬ���� |
| D����ͬ�����£������ʵ����ĵ������������Ϸų������Ķ��٣�N��Z |
��֪A��B��C��D��������֮���ת����ϵ��ͼ��ʾ������˵����ȷ���ǣ�������


| A����AΪNa��DΪ��������B-��Ϊˮ |
| B����A��DΪ�����BΪˮ����Cһ�������嵥�� |
| C����A��B��C��D��Ϊ�������÷�Ӧһ�����ڸ��ֽⷴӦ |
| D����A��DΪ�����BΪ���ʣ���÷�Ӧһ������������ԭ��Ӧ |
��CH3COONa��Һ�У�������Ũ�ȹ�ϵ������ǣ�������
| A��c��Na+ ��+c��H+���Tc��CH3COO- ��+c��OH- �� |
| B��c��OH- ���Tc��H+ ��+c��CH3COOH�� |
| C��c��Na+ ��=c��CH3COO- ��+c��CH3COOH�� |
| D��c��Na+ ����c��CH3COO- ����c��H+ ����c��OH- �� |
������������Һ���ܴ���������ǣ�������
| A��K+ H+ Fe2+ NO3- |
| B��H+ Al3+ SO42- Cl- |
| C��Na+ Al3+ HCO3- Cl- |
| D��Na+ NH4+ OH- CO32- |
����0.1mol/L Na2CO3��Һ������˵����ȷ���ǣ�������
| A�������¶ȣ���Һ��pH���� |
| B��c��Na+��=2c��CO32-��+c��HCO3-��+c��H2CO3�� |
| C����������NaOH���壬c��CO32-����c��Na+�������� |
| D��c��Na+��+c��H+��=2c��CO32-��+2c��HCO3-��+c��OH-�� |