题目内容
在CH3COONa溶液中,各微粒的浓度关系错误的是( )
| A、c(Na+ )+c(H+)═c(CH3COO- )+c(OH- ) |
| B、c(OH- )═c(H+ )+c(CH3COOH) |
| C、c(Na+ )=c(CH3COO- )+c(CH3COOH) |
| D、c(Na+ )>c(CH3COO- )>c(H+ )>c(OH- ) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:CH3COONa为强碱弱酸盐,CH3COO-水解而使其溶液呈碱性,溶液中存在电荷守恒和物料守恒、质子守恒,根据电荷守恒、物料守恒和质子守恒解答.
解答:
解:A.根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故A正确;
B.根据质子守恒得c(OH-)=c(H+)+c(CH3COOH),故B正确;
C.根据物料守恒得c(Na+)=c(CH3COO-)+c(CH3COOH),故C正确;
D.CH3COONa为强碱弱酸盐,CH3COO-水解而使其溶液呈碱性,所以c(H+)<c(OH-),故D错误;
故选D.
B.根据质子守恒得c(OH-)=c(H+)+c(CH3COOH),故B正确;
C.根据物料守恒得c(Na+)=c(CH3COO-)+c(CH3COOH),故C正确;
D.CH3COONa为强碱弱酸盐,CH3COO-水解而使其溶液呈碱性,所以c(H+)<c(OH-),故D错误;
故选D.
点评:本题考查了离子浓度大小比较,离子浓度大小比较常常与弱电解质电离、盐类水解综合考查,根据盐类水解及弱电解质电离特点结合守恒思想来分析解答,题目难度不大.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
下列各离子组中,一定能大量共存的一组是( )
| A、pH=1的溶液中:Fe2+、Cl-、Na+、NO3- |
| B、由水电离出的c(H+)=1×10-13mol/L溶液中:Na+、CO32-、Cl-、K+ |
| C、pH=7的溶液中:NH4+、HCO3-、Mg2+、SO42- |
| D、无色溶液中:Al3+、HCO3-、I-、Ca2+ |
在一个固定体积的密闭容器中,加入2molA和1molB发生如下反应:2A(g)+B(g)?3C(g)+D(g).达到平衡时C的浓度为Wmol/l.若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡时,C的浓度仍为Wmol/L的是( )
| A、3molC+1molD |
| B、2molA+2molC |
| C、2molA+1molB+0.5molD |
| D、1molA+0.5molB+1.5molC+0.5molD |
化学与生产、生活密切相关.下列叙述正确的是( )
| A、二氧化硫的大量排放是造成光化学烟雾的主要原因 |
| B、使用清洁能源是防止酸雨发生的重要措施之一 |
| C、使用无磷洗衣粉,可彻底解决水体富营养化问题 |
| D、某雨水样品放置一段时间后pH减小是因为水中溶解的CO2增多 |
 选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、铁棒、铜棒、铂棒,组成如图所示的原电池装置(只有两个电极),观察到电流计G的指针均明显偏转,则其可能的组合共有( )
选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、铁棒、铜棒、铂棒,组成如图所示的原电池装置(只有两个电极),观察到电流计G的指针均明显偏转,则其可能的组合共有( )| A、6种 | B、5种 | C、4种 | D、3种 |
下列用来表示物质变化的化学用语中,正确的是( )
| A、用惰性电极电解饱和食盐水时,阳极的电极反应式为2Cl--2e-=Cl2↑ |
| B、在碱性介质中,氢氧燃料电池的负极反应式为O2+2H2O+4e-=4OH- |
| C、粗铜精炼时,与电源正极相连的是纯铜,电极反应式为Cu-2e-=Cu2+ |
| D、钢铁发生电化学腐蚀的正极反应式为Fe-2e-=Fe2+ |


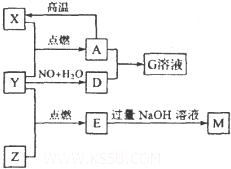 几种常见物质之间存在如图转化关系,其中X、Y、Z为单质,其他物质均为化合 物.已知Y为无色无味气体,E为无色有刺激性气味气体,能使品红溶液退色,G溶液呈黄色,它们之间(部分产物及条件略去).请回答下列问题:
几种常见物质之间存在如图转化关系,其中X、Y、Z为单质,其他物质均为化合 物.已知Y为无色无味气体,E为无色有刺激性气味气体,能使品红溶液退色,G溶液呈黄色,它们之间(部分产物及条件略去).请回答下列问题: