题目内容
14.各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )| A. | 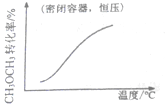 CH3OCH3(g)+3H2O(g)?6H2(g)+2CO2(g):△H>0 | B. | 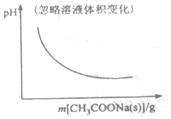 CH3COOH?H++CH3COO- | ||
| C. | 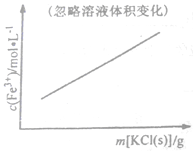 FeCl3+3KSCN?Fe(SCN)3+3KCl | D. | 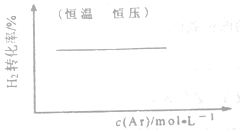 N2(g)+3H2(g)?2NH3(g) |
分析 A.正反应吸热,升高温度,化学平衡正向移动;
B.向醋酸溶液中加入醋酸钠固体,增大了c(CH3COO-),电离平衡逆向移动;
C.根据反应的离子方程式为Fe3++3SCN-?Fe(SCN)3判断;
D.保持压强不变,充入氩气,平衡逆向移动.
解答 解:A.正反应吸热,升高温度,化学平衡正向移动,CH3OCH3的转化率增大,故A正确;
B.向醋酸溶液中加入醋酸钠固体,增大了c(CH3COO-),CH3COOH?H++CH3COO-逆向移动,c(H+)减小,pH值增大,故B错误;
C.该反应的实质为Fe3++3SCN-?Fe(SCN)3,加入KCl,化学平衡不移动,因此c(Fe3+)不变,故C错误;
D.保持压强不变,充入氩气,相当于减小压强,平衡逆向移动,则氢气的转化率减小,故D错误.
故选A.
点评 本题考查以图象为载体综合考查化学反应与能量变化、电离平衡、化学平衡的移动等知识,为高频考点,侧重考查学生的分析能力,注意把握图象曲线变化的特点以及平衡移动的影响因素,难度中等.

练习册系列答案
相关题目
5.铝的熔沸点比镁高的原因是( )
| A. | 镁比铝活泼 | B. | 铝的化合价比镁高 | ||
| C. | 铝能与酸碱反应 | D. | 铝比镁的价电子多,半径比镁小 |
2.有关硅及其化合物的叙述正确的是( )
| A. | 二氧化硅与任何酸都不反应 | |
| B. | 硅太阳能电池、计算机芯片、光导纤维都用到硅单质 | |
| C. | 硅的性质很稳定,能以单质形式存在于地壳中 | |
| D. | 水泥路桥、门窗玻璃、砖瓦、陶瓷餐具所用材料为硅酸盐 |
9.苯甲酸乙酯可用作食用香料.某小组用如下装置制备苯甲酸乙酯反应原理:
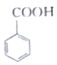 (苯甲酸)+C2H5OH$?_{△}^{浓硫酸}$
(苯甲酸)+C2H5OH$?_{△}^{浓硫酸}$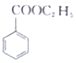 (苯甲酸乙酯)+H2O
(苯甲酸乙酯)+H2O
产物和部分反应物相关数据如表:
实验步骤:
①在B中加入的物质有:12.2g苯甲酸、10mL乙醇、10mL浓硫酸和沸石;
②按图甲安装好仪器,水浴加热,回流2小时;
③冷却后将B中液体与30mL水混合,并分批加入碳酸钠粉末;
④分液,取出有机层并加入适量MgSO4摇匀;
⑤按图乙装置安好仪器,加热精馏④所得有机物,收集产品.
回答下列问题:
(1)仪器C的名称蒸馏烧瓶.
(2)步骤①若加热后才发现未加沸石,应采取的措施是停止加热,待反应液冷却后,再补加沸石;步骤②采取水浴加热的优点是便于控制温度且受热均匀.
(3)步骤③为了预防液体因瞬时放出大量热而飞溅,将有机物与水混合的操作是将B中液体沿器壁缓慢加入水中并不断搅拌.
(4)步骤④分液时除了要用到烧杯,还需要的主要玻璃仪器有分液漏斗,使用该仪器之前需要进行的操作是检漏;无水MgSO4的作用是作干燥剂.
(5)步骤⑤收集馏分应控制的最佳温度为213℃.
(6)为了提高苯甲酸乙酯的产率,可以采取的措施增大乙醇的用量、对③中水层进行再萃取或适当增加浓H2SO4用量(任填一种).

 (苯甲酸)+C2H5OH$?_{△}^{浓硫酸}$
(苯甲酸)+C2H5OH$?_{△}^{浓硫酸}$ (苯甲酸乙酯)+H2O
(苯甲酸乙酯)+H2O产物和部分反应物相关数据如表:
| 物质 | 苯甲酸 | 乙醇 | 苯甲酸乙酯 |
| 熔点/℃ | 122.1 | -117.3 | -34.6 |
| 沸点/℃ | 249 | 78.3 | 213 |
①在B中加入的物质有:12.2g苯甲酸、10mL乙醇、10mL浓硫酸和沸石;
②按图甲安装好仪器,水浴加热,回流2小时;
③冷却后将B中液体与30mL水混合,并分批加入碳酸钠粉末;
④分液,取出有机层并加入适量MgSO4摇匀;
⑤按图乙装置安好仪器,加热精馏④所得有机物,收集产品.
回答下列问题:
(1)仪器C的名称蒸馏烧瓶.
(2)步骤①若加热后才发现未加沸石,应采取的措施是停止加热,待反应液冷却后,再补加沸石;步骤②采取水浴加热的优点是便于控制温度且受热均匀.
(3)步骤③为了预防液体因瞬时放出大量热而飞溅,将有机物与水混合的操作是将B中液体沿器壁缓慢加入水中并不断搅拌.
(4)步骤④分液时除了要用到烧杯,还需要的主要玻璃仪器有分液漏斗,使用该仪器之前需要进行的操作是检漏;无水MgSO4的作用是作干燥剂.
(5)步骤⑤收集馏分应控制的最佳温度为213℃.
(6)为了提高苯甲酸乙酯的产率,可以采取的措施增大乙醇的用量、对③中水层进行再萃取或适当增加浓H2SO4用量(任填一种).
19.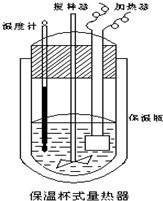 在如图所示的量热计中,将100mL0.50mol•L-1CH3COOH溶液与100mL0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为4.184J•g-1•℃-1,两溶液的密度均近似为1g•mL-1.下列说法错误的是( )
在如图所示的量热计中,将100mL0.50mol•L-1CH3COOH溶液与100mL0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为4.184J•g-1•℃-1,两溶液的密度均近似为1g•mL-1.下列说法错误的是( )
 在如图所示的量热计中,将100mL0.50mol•L-1CH3COOH溶液与100mL0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为4.184J•g-1•℃-1,两溶液的密度均近似为1g•mL-1.下列说法错误的是( )
在如图所示的量热计中,将100mL0.50mol•L-1CH3COOH溶液与100mL0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为4.184J•g-1•℃-1,两溶液的密度均近似为1g•mL-1.下列说法错误的是( )| A. | CH3COOH溶液与NaOH溶液的反应为吸热反应 | |
| B. | 所加NaOH溶液过量,目的是保证CH3COOH溶液完全被中和 | |
| C. | 若量热计的保温瓶绝热效果不好,则所测△H偏大 | |
| D. | CH3COOH的中和热△H为-53.3KJ•mol-1 |
5.现有下列短周期元素性质的数据:
(1)上述元素中处于同一主族的有③和⑥、④和⑦;处于第3周期的有②④⑤⑥⑧;(以上均用编号表示).
(2)已知A元素原子的M层上的电子数是K层电子数的3倍,则A在周期表中位置为第3周期ⅥA族;
B元素原子的次外层电子数是最外层电子数的$\frac{1}{4}$,则B原子的结构示意图为 .
.
(3)三氧化铀是一种两性氧化物,它在溶液中可以以UO22+和U2O72-形式存在,按要求写出UO3与强酸、强碱反应的离子方程式:
①UO3与强碱反应2UO3+2OH-=U2O72-+H2O;
②UO3与强酸反应UO3+2H+=UO22++H2O.
 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10 m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低负化合价 | -2 | -3 | -1 | -3 |
(2)已知A元素原子的M层上的电子数是K层电子数的3倍,则A在周期表中位置为第3周期ⅥA族;
B元素原子的次外层电子数是最外层电子数的$\frac{1}{4}$,则B原子的结构示意图为
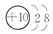 .
.(3)三氧化铀是一种两性氧化物,它在溶液中可以以UO22+和U2O72-形式存在,按要求写出UO3与强酸、强碱反应的离子方程式:
①UO3与强碱反应2UO3+2OH-=U2O72-+H2O;
②UO3与强酸反应UO3+2H+=UO22++H2O.
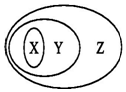 用如图表示的一些物质或概念间的从属关系中不正确的是( )
用如图表示的一些物质或概念间的从属关系中不正确的是( )