题目内容
5.现有下列短周期元素性质的数据: | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10 m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低负化合价 | -2 | -3 | -1 | -3 |
(2)已知A元素原子的M层上的电子数是K层电子数的3倍,则A在周期表中位置为第3周期ⅥA族;
B元素原子的次外层电子数是最外层电子数的$\frac{1}{4}$,则B原子的结构示意图为
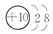 .
.(3)三氧化铀是一种两性氧化物,它在溶液中可以以UO22+和U2O72-形式存在,按要求写出UO3与强酸、强碱反应的离子方程式:
①UO3与强碱反应2UO3+2OH-=U2O72-+H2O;
②UO3与强酸反应UO3+2H+=UO22++H2O.
分析 由元素的性质可知,①为O,⑦为N,③为Li,⑥为Na,②为Mg,④为P,⑤为Cl,⑧为Al;
(1)Na、Li位于IA族,N、P位于ⅤA族,除①③⑦位于第二周期,其它均为第三周期元素;
(2)A元素原子的M层上的电子数是K层电子数的3倍,M层电子为6,A为S元素;
B元素原子的次外层电子数是最外层电子数的$\frac{1}{4}$,B为Ne元素;
(3)UO3与强酸、强碱反应生成盐和水.
解答 解:由元素的性质可知,①为O,⑦为N,③为Li,⑥为Na,②为Mg,④为P,⑤为Cl,⑧为Al;
(1)上述元素中处于同一主族的有③和⑥、④和⑦,处于第3周期的有②④⑤⑥⑧,故答案为:③和⑥、④和⑦;②④⑤⑥⑧;
(2)A元素原子的M层上的电子数是K层电子数的3倍,M层电子为6,A为S元素,位于第3周期ⅥA族,故答案为:第3周期ⅥA族;
B元素原子的次外层电子数是最外层电子数的$\frac{1}{4}$,B为Ne元素,其原子结构示意图为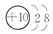 ,故答案为:
,故答案为: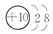 ;
;
(3)①UO3与强碱反应的离子反应为2UO3+2OH-=U2O72-+H2O,故答案为:2UO3+2OH-=U2O72-+H2O;
②UO3与强酸反应的离子反应为UO3+2H+=UO22++H2O,故答案为:UO3+2H+=UO22++H2O.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意两性氧化物的应用,题目难度不大.

练习册系列答案
相关题目
14.各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )
| A. | 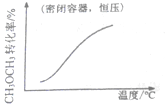 CH3OCH3(g)+3H2O(g)?6H2(g)+2CO2(g):△H>0 | B. | 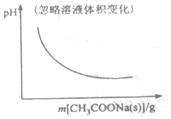 CH3COOH?H++CH3COO- | ||
| C. | 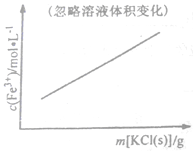 FeCl3+3KSCN?Fe(SCN)3+3KCl | D. | 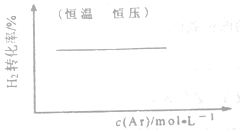 N2(g)+3H2(g)?2NH3(g) |
10.下列表示物质的化学用语正确的是( )
| A. | 聚丙烯的结构简式为: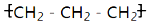 | B. | 硝基苯的结构简式: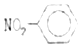 | ||
| C. | 葡萄糖的实验式:CH2O | D. | 甲烷分子的比例模型: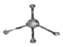 |
14.两种碱的混合物共8g与100mL2mol/L的盐酸恰好完全反应,则混合物组成可能是( )
| A. | NaOH、KOH | B. | NaOH、Cu(OH)2 | C. | Fe(OH)2、Cu(OH)2 | D. | Fe(OH)2、Fe(OH)3 |

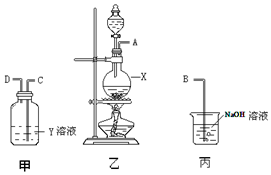 某化学课外兴趣小组为探究铜与浓硫酸反应气体产物的性质,拟用图所示的装置的组合进行实验.
某化学课外兴趣小组为探究铜与浓硫酸反应气体产物的性质,拟用图所示的装置的组合进行实验.