题目内容
已知:2X(g)+Y(g)?a Z(g),T1温度时,在体积为2L的密闭容器中充入6molX和2molY,根据图示回答:

(1)a= ;用X的浓度变化表示从反应开始到平衡时的平均反应速率为 mol/(L?min).
(2)平衡时,Y在混合物中的物质的量分数是 .
(3)下列选项能说明反应达到平衡状态的是 (选填字母).
A.容器内压强保持不变 B.容器内密度保持不变
C.X的物质的量不再变化 D.υ(X)正=υ(Z)逆
(4)其他条件相同时,若升高温度到T2时,反应的平衡常数为1,下列措施可以提高Y的转化率的是 (选填字母).
A.选择适当的催化剂 B.分离出ZC.增大压强 D.升高温度
(5)X、Y、Z由C、H、O三种元素中的一种或几种组成,信息如下:
①则Z的分子式为 .
②根据燃烧热数据分析,等质量的X、Y、Z充分燃烧,放出热量最多的是
(填分子式).

(1)a=
(2)平衡时,Y在混合物中的物质的量分数是
(3)下列选项能说明反应达到平衡状态的是
A.容器内压强保持不变 B.容器内密度保持不变
C.X的物质的量不再变化 D.υ(X)正=υ(Z)逆
(4)其他条件相同时,若升高温度到T2时,反应的平衡常数为1,下列措施可以提高Y的转化率的是
A.选择适当的催化剂 B.分离出ZC.增大压强 D.升高温度
(5)X、Y、Z由C、H、O三种元素中的一种或几种组成,信息如下:
| 物质 | X | Y | Z |
| 所含元素种数 | 1 | 2 | 3 |
| 分子中的电子总数 | 大于10 | 18 | |
| 燃烧热(kJ/mol) | -285.8 | -283 | -726.5 |
②根据燃烧热数据分析,等质量的X、Y、Z充分燃烧,放出热量最多的是
(填分子式).
考点:物质的量或浓度随时间的变化曲线
专题:
分析:(1)各物质的化学计量数之比等于浓度变化量之比;根据反应速率v=
计算;
(2)根据Y在混合物中的物质的量分数=
×100%计算;
(3)平衡时正逆反应速率相等,各组分浓度不变;
(4)平衡常数等于生成物浓度系数次幂与反应物浓度系数次幂的比值;
(5)根据元素种类和电子总数判断分子式,燃烧热为1mol可燃物完全燃烧生成稳定氧化物放出的热量.
| △c |
| △t |
(2)根据Y在混合物中的物质的量分数=
| n(Y) |
| n(总) |
(3)平衡时正逆反应速率相等,各组分浓度不变;
(4)平衡常数等于生成物浓度系数次幂与反应物浓度系数次幂的比值;
(5)根据元素种类和电子总数判断分子式,燃烧热为1mol可燃物完全燃烧生成稳定氧化物放出的热量.
解答:
解:(1)在体积为2L的密闭容器中充入6molX和2molY,X、Y的起始浓度分别为3mol/L、1mol/L,平衡时X、Y、Z浓度变化之比为△c(x):(1.00mol/L-0.25mol/l):0.75mol/L=2:1:1,故a=1,△c(x)=1.5mol/L,用X的浓度变化表示从反应开始到平衡时的平均反应速率为
=
=0.15mol/L,故答案为:1;0.15mol/(L?min);
(2)平衡时n(X)=(3mol/L-1.5mol/L)×2L=3mol,n(Y)=0.25mol/L×2L=0.5mol,n(Z)=0.75mol/L×2L=1.5mol,则Y在混合物中的物质的量分数=
×100%=
×100%=10%,
故答案为:10%;
(3)反应2X(g)+Y(g)?Z(g),
A.反应2X(g)+Y(g)?Z(g)是一个气体体积减小的反应,容器内压强保持不变,说明反应达到平衡状态,故A正确;
B.容器体积不变,混合气体质量不变,则密度不变,故容器内密度保持不变不能说明反应达到平衡状态,故B错误;
C.X的物质的量不再变化,说明X的生成速率和消耗速率相等,反应达到平衡状态,故C正确;
D.反应速率之比等于计量数之比,υ(X)正=υ(Z)逆不能说明反应达到平衡状态,故B错误;
故答案为:AC;
(4)T1温度时,平衡常数K=
=
>1,故升温平衡逆向移动,正反应方向为放热反应,提高Y的转化率,即使平衡正向移动,
A.催化剂不影响平衡平衡,故A错误;
B.分离出Z,平衡正向移动,故B正确;
C.增大压强,平衡正向移动,故C正确;
D.升高温度,平衡逆向移动,故D错误;
故答案为:BC;
(5)①反应2X(g)+Y(g)?Z(g)中X为一种元素组成,Y为2种元素组成,X为3种元素组成,故X为H2,Y为CO,Z为CH4O,
故答案为:CH4O;
②1molH2,CO,CH4O放出的热量分别为285.8KJ,283KJ,726.5KJ,等质量的X、Y、Z充分燃烧,放出热量比值为
:
:
,故放出热量最多的是H2,
故答案为:H2.
| △c |
| △t |
| 1.5mol/L |
| 10min |
(2)平衡时n(X)=(3mol/L-1.5mol/L)×2L=3mol,n(Y)=0.25mol/L×2L=0.5mol,n(Z)=0.75mol/L×2L=1.5mol,则Y在混合物中的物质的量分数=
| n(Y) |
| n(总) |
| 0.5mol |
| 3mol+0.5mol+1.5mol |
故答案为:10%;
(3)反应2X(g)+Y(g)?Z(g),
A.反应2X(g)+Y(g)?Z(g)是一个气体体积减小的反应,容器内压强保持不变,说明反应达到平衡状态,故A正确;
B.容器体积不变,混合气体质量不变,则密度不变,故容器内密度保持不变不能说明反应达到平衡状态,故B错误;
C.X的物质的量不再变化,说明X的生成速率和消耗速率相等,反应达到平衡状态,故C正确;
D.反应速率之比等于计量数之比,υ(X)正=υ(Z)逆不能说明反应达到平衡状态,故B错误;
故答案为:AC;
(4)T1温度时,平衡常数K=
| c(Z) |
| c2(X)c(Y) |
| 0.75 |
| 1.52×0.25 |
A.催化剂不影响平衡平衡,故A错误;
B.分离出Z,平衡正向移动,故B正确;
C.增大压强,平衡正向移动,故C正确;
D.升高温度,平衡逆向移动,故D错误;
故答案为:BC;
(5)①反应2X(g)+Y(g)?Z(g)中X为一种元素组成,Y为2种元素组成,X为3种元素组成,故X为H2,Y为CO,Z为CH4O,
故答案为:CH4O;
②1molH2,CO,CH4O放出的热量分别为285.8KJ,283KJ,726.5KJ,等质量的X、Y、Z充分燃烧,放出热量比值为
| 285.5 |
| 2 |
| 283 |
| 28 |
| 726.5 |
| 32 |
故答案为:H2.
点评:本题考查了反应速率的计算,化学平衡影响因素,平衡状态的判断,燃烧热的应用等知识点,综合性较强,难度中等.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
下列关于有机化合物的说法正确的是( )
| A、糖类、油脂、蛋白质都属于天然高分子化合物 |
| B、分子式为C2H6O、C4H10的有机物都有2种同分异构体 |
| C、乙烯和苯都能使酸性KMnO4溶液褪色 |
| D、可用热的NaOH溶液除去乙酸乙酯中的乙酸杂质 |
下列说法正确的是( )
A、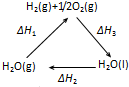 △H1=△H2+△H3 |
B、 在催化剂条件下,反应的活化能等于E1+E2 |
C、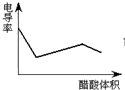 表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线 |
D、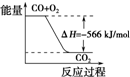 可表示由CO(g)生成CO2(g)的反应过程和能量关系 |
下列物质转化无法实现的是( )
A、Al2O3
| |||||
B、S
| |||||
C、Fe2O3
| |||||
D、MgCl2(aq)
|


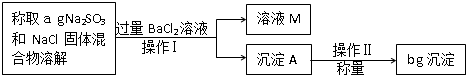
 某校化学小组的同学开展测定Na2SO3和NaCl的固体混合物中Na2SO3质量分数的探究实验,他们提出下列实验方案:
某校化学小组的同学开展测定Na2SO3和NaCl的固体混合物中Na2SO3质量分数的探究实验,他们提出下列实验方案: