题目内容
15.NiCl2是化工合成中最重要的镍源,工业上以金属镍废料为原料生产NiCl2继而生产Ni2O3的工艺流程如下:
如表,列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等.沉镍前需加Na2CO3控制溶液pH范围为4.7~7.1.
(3)从滤液A中可回收利用的主要物质是NaCl.
(4)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.
(5)工业上用镍为阳极,电解0.05~0.1mol•L-1NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉.当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图2所示:
①NH4Cl的浓度最好控制为10 g•L-1.
②当NH4Cl浓度大于15g•L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:2H++2e-=H2↑(或2NH4++2H2O+2e-=H2↑+2NH3•H2O).
分析 酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等,加入过氧化氢氧化亚铁离子为铁离子,加入碳酸钠溶液调节溶液的pH,使铝离子、铁离子全部沉淀,过滤后的滤液中再加入碳酸钠沉淀镍离子得NiCO3,滤液A中含有NaCl等物质,将NiCO3再溶于盐酸,得氯化镍溶液,向其中加入次氯酸钠和氢氧化钠溶液可得Ni2O3.
(1)升高温度、增大酸的浓度、充分搅拌、增大接触面积等可以提高浸出的速率;
(2)沉镍前要将铝离子和铁离子沉淀完全,而镍离子不能产生沉淀;
(3)滤液A中主要含有氯化钠,可回收利用;
(4)Cl元素由+1价降低到-1价,即反应生成NaCl,而Ni由+2价升高到+3价,根据原子守恒与电子转移守恒配平;
(5)①选择镍的成粉率最高的浓度;
②当NH4Cl浓度大于15g•L-1时,阴极有氢气生成,导致阴极电流效率降低.
解答 解:酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等,加入过氧化氢氧化亚铁离子为铁离子,加入碳酸钠溶液调节溶液的pH,使铝离子、铁离子全部沉淀,过滤后的滤液中再加入碳酸钠沉淀镍离子得NiCO3,滤液A中含有NaCl等物质,将NiCO3再溶于盐酸,得氯化镍溶液,向其中加入次氯酸钠和氢氧化钠溶液可得Ni2O3.
(1)为了提高金属镍废料浸出的速率,还可以增大盐酸的浓度(或将镍废料研成粉末等)等,
故答案为:增大盐酸的浓度(或将镍废料研成粉末等);
(2)沉镍前要将铝离子和铁离子沉淀完全,而镍离子不能产生沉淀,所以溶液的PH值控制在4.7~7.1,
故答案为:4.7~7.1;
(3)滤液A中主要含有氯化钠,可回收利用,
故答案为:NaCl;
(4)Cl元素由+1价降低到-1价,即反应生成NaCl,而Ni由+2价升高到+3价,生成Ni2O3,反应离子方程式为:2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O,
故答案为:2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O;
(5)①根据图2可知,NH4Cl的浓度为10g•L-1时,镍的成粉率最高,所以NH4Cl的浓度最好控制为10 g•L-1,
故答案为:10 g•L-1;
②当NH4Cl浓度大于15g•L-1时,阴极有氢气生成,导致阴极电流效率降低,电极反应式为2H++2e-=H2↑(或2NH4++2H2O+2e-=H2↑+2NH3•H2O),
故答案为:2H++2e-=H2↑(或2NH4++2H2O+2e-=H2↑+2NH3•H2O).
点评 本题考查物质制备工艺流程,涉及反应速率影响因素、条件控制、陌生方程式书写、电解原理、信息获取能力等,是高考常考题型,是对学生综合能力的考查.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案| A. | 氢能 | B. | 太阳能 | C. | 风能 | D. | 化石燃料 |
| A. | 通式CnH2n+2 只表示一类物质 | |
| B. | C3H8光照下与氯气反应,最多能生成四种二氯代烃 | |
| C. | 戊烷有3种同分异构体 | |
| D. | 甲苯一氯取代物有3种 |
| A. | 凡是含有食品添加剂的食物对人体健康有害,不宜食用 | |
| B. | 乙醇和汽油都属于可再生能源,应大力推广使用乙醇汽油 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | PM2.5是指大气中直径≤2.5微米的颗粒物,其颗粒直径小,面积大,活性强,易附带有毒、有害物质(如重金属、微生物等),对人体健康和大气环境质量的影响很大 |
①2KClO3+4MnO2═2KCl+2Mn2O7 慢
②2Mn2O7═4MnO2+3O2 快
下列有关说法不正确的是( )
| A. | 1molKClO3所具有的总能量高于1molKCl所具有的总能量 | |
| B. | KClO3分解速率快慢主要取决于反应① | |
| C. | 1gKClO3,1gMnO2,0.1g Mn2O7混合加热,充分反应后MnO2质量为1g | |
| D. | 将固体二氧化锰碾碎,可加快KClO3的分解速率 |
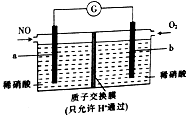 用NO生产硝酸,可以有效消除污染,其原理如图所示.下列说法正确的是( )
用NO生产硝酸,可以有效消除污染,其原理如图所示.下列说法正确的是( )| A. | a极是该电极的正极 | |
| B. | 电流由a极经导线流向b极 | |
| C. | a极的电极反应式为NO-3e-+2H2O═NO3-+4H+ | |
| D. | 若消耗2.24L(标准状况下)氧气,则会有0.4 molH+通过质子交换膜进入a极区 |
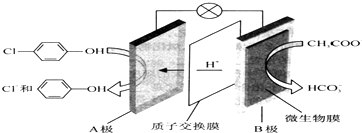
| A. | B为电池的正极,发生还原反应 | |
| B. | A极的电极反应式为: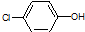 +e-=Cl-+ +e-=Cl-+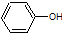 | |
| C. | 电流方向为从B极沿导线经小灯泡流向A极 | |
| D. | 当外电路中有0.2mole-转移时,通过质子交换膜的H+个数为0.2NA |
 某学生欲通过实验方法验证 Fe2+的性质.
某学生欲通过实验方法验证 Fe2+的性质.(1)该同学在实验前,依据Fe2+的还原性,填写了表格.
| 实验操作 | 预期现象 | 反应的离子方程式 |
| 向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红综色气体,溶液颜色逐渐变黄 | Fe2++NO3-+2H+═Fe3++NO2↑+H2O |
(2)向原新制FeSO4溶液和反应溶液后溶液中均加入KSCN溶液,前者不变红色,后者变红.该现象的结论是Fe2+被硝酸氧化为Fe3+.
(3)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe3+或Fe2+发生反应而得到的.为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.
ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液并无明显变化.
ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应.ⅲ为与ⅰ中实验进行对照,更换丙丁后,使甲中反应继续,观察到的现象与步骤ⅰ中相同.
①铜与足量浓硝酸反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O;
②装置乙的作用是使NO2转化为NO;
③步骤ⅱ目的是排出乙右侧装置中残留的NO2;
④该实验可得出的结论是溶液的深棕色是由Fe2+与NO或NO2作用得到.
(4)该同学重新进行(1)中实验,观察到了预期现象,其实验操作是向盛有浓硝酸的试管中滴入数滴新制FeSO4溶液,振荡.
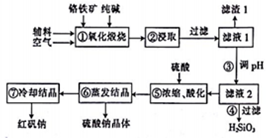 红矾钠(重铬酸钠:Na2Cr2O7•2H2O)是重要的化工原料,在印染、电镀等行业应用十分广泛.工业上以铬铁矿(主要成分为FeO•Cr2O3,还含少量SiO2)为原料制取红矾钠的流程如图所示.
红矾钠(重铬酸钠:Na2Cr2O7•2H2O)是重要的化工原料,在印染、电镀等行业应用十分广泛.工业上以铬铁矿(主要成分为FeO•Cr2O3,还含少量SiO2)为原料制取红矾钠的流程如图所示.