题目内容
20.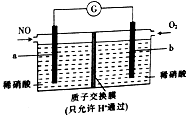 用NO生产硝酸,可以有效消除污染,其原理如图所示.下列说法正确的是( )
用NO生产硝酸,可以有效消除污染,其原理如图所示.下列说法正确的是( )| A. | a极是该电极的正极 | |
| B. | 电流由a极经导线流向b极 | |
| C. | a极的电极反应式为NO-3e-+2H2O═NO3-+4H+ | |
| D. | 若消耗2.24L(标准状况下)氧气,则会有0.4 molH+通过质子交换膜进入a极区 |
分析 用NO生产硝酸,其原理:在正极上市氧气得电子的还原反应O2+4e-+4H+=2H2O,在负极上是NO失电子的氧化反应NO-3e-+2H2O═NO3-+4H+,电子从负极流向正极,电流从正极流向负极,根据原电池的工作原理进行回答即可.
解答 解:用NO生产硝酸,其原理:在正极上市氧气得电子的还原反应O2+4e-+4H+=2H2O,在负极上是NO失电子的氧化反应NO-3e-+2H2O═NO3-+4H+,
A、a极上是NO失电子的氧化反应NO-3e-+2H2O═NO3-+4H+,是该电极的负极,故A错误;
B、电流从正极流向负极,a是负极,b是正极,电流由b极经导线流向a极,故B错误;
C、a极上是NO失电子的氧化反应NO-3e-+2H2O═NO3-+4H+,故C正确;
D、正极上市氧气得电子的还原反应O2+4e-+4H+=2H2O,若消耗2.24L即0.1mol(标准状况下)氧气,则转移单子是0.4mol,会有0.4 molH+通过质子交换膜进入b极区,阳离子移向正极,故D错误.
故选C.
点评 本题考查了原电池原理的应用等,题目涉及的知识点较多,侧重于考查学生的综合运用能力,难度中等,注意基础知识的积累掌握.

练习册系列答案
相关题目
17.下列气体有颜色的是( )
| A. | SO2 | B. | NO2 | C. | Cl2 | D. | CH4 |
11.化学与人类生产、生活密切相关,下列说法正确的是( )
| A. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| B. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 | |
| C. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| D. | 用含有橙色的酸性重铬酸钾的仪器检验酒后驾车,利用了乙醇的氧化性 |
8.下列化学用语和描述均正确的是( )
| A. | 空气中结构式为O-C-O的分子含量过多会造成温室效应 | |
| B. | 结构示意图为 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | |
| C. | 球棍模型为 的分子可发生加成反应 的分子可发生加成反应 | |
| D. | 电子式分别为Na+[ ]2-Na+和 ]2-Na+和 的两种化合物均为常见的氧化剂 的两种化合物均为常见的氧化剂 |
15.NiCl2是化工合成中最重要的镍源,工业上以金属镍废料为原料生产NiCl2继而生产Ni2O3的工艺流程如下:

如表,列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③增大盐酸的浓度(或将镍废料研成粉末等)等.
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等.沉镍前需加Na2CO3控制溶液pH范围为4.7~7.1.
(3)从滤液A中可回收利用的主要物质是NaCl.
(4)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.
(5)工业上用镍为阳极,电解0.05~0.1mol•L-1NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉.当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图2所示:
①NH4Cl的浓度最好控制为10 g•L-1.
②当NH4Cl浓度大于15g•L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:2H++2e-=H2↑(或2NH4++2H2O+2e-=H2↑+2NH3•H2O).

如表,列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等.沉镍前需加Na2CO3控制溶液pH范围为4.7~7.1.
(3)从滤液A中可回收利用的主要物质是NaCl.
(4)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.
(5)工业上用镍为阳极,电解0.05~0.1mol•L-1NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉.当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图2所示:
①NH4Cl的浓度最好控制为10 g•L-1.
②当NH4Cl浓度大于15g•L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:2H++2e-=H2↑(或2NH4++2H2O+2e-=H2↑+2NH3•H2O).
5.短周期元素W、X、Y、Z的原子序数依次增大且互不同主族,W元素在自然界中存在两种气态单质,其中一种能吸收短波紫外线;W、X两元素的族序数之差为3;Y、Z不相邻,Y的最外层电子数是次外层电子数的一半.下列判断正确的是( )
| A. | 简单离子的半径大小:Z>X>W | |
| B. | 最高价氧化物对应水化物的酸性:Y>Z | |
| C. | W分别与Y、Z形成的化合物均易溶于水 | |
| D. | X的单质既能和酸反应,又能和碱反应 |
9.吸热反应一定是( )
| A. | 释放能量 | |
| B. | 储存能量 | |
| C. | 反应物的总能量低于生成物的总能量 | |
| D. | 反应物的总能量高于生成物的总能量 |
10.下列实验操作不正确的是( )
| A. | 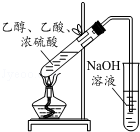 实验室中制取少量的乙酸乙酯 | |
| B. | 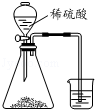 比较硫、碳、硅三种元素的非金属性强弱 | |
| C. | 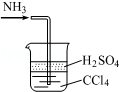 处理尾气 | |
| D. | 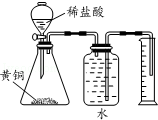 测定黄铜(Cu、Zn合金)中Zn 的含量 |