题目内容
4.近期“五水共治”越来越引起人们的重视,已知可以通过微电池除去废水中的乙酸钠和对氯苯酚其原理如图所示,下列说法正确的是( )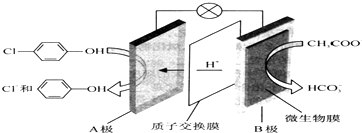
| A. | B为电池的正极,发生还原反应 | |
| B. | A极的电极反应式为: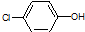 +e-=Cl-+ +e-=Cl-+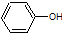 | |
| C. | 电流方向为从B极沿导线经小灯泡流向A极 | |
| D. | 当外电路中有0.2mole-转移时,通过质子交换膜的H+个数为0.2NA |
分析 原电池中阳离子移向正极,根据原电池中氢离子的移动方向可知A为正极,正极有氢离子参与反应,电极反应式为Cl- -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-,电流从正极经导线流向负极,以此解答该题.
-OH+Cl-,电流从正极经导线流向负极,以此解答该题.
解答 解:原电池中阳离子移向正极,根据原电池中氢离子的移动方向可知A为正极,正极有氢离子参与反应,电极反应式为Cl- -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-,电流从正极经导线流向负极,
-OH+Cl-,电流从正极经导线流向负极,
A.A为正极,发生还原反应,B为负极发生氧化反应,故A错误;
B.BA为正极,正极有氢离子参与反应,电极反应式为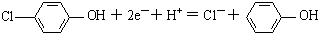 ,故B错误;
,故B错误;
C.电流从正极A沿导线流向负极B,故C错误;
D.据电荷守恒,当外电路中有0.2mole-转移时,通过质子交换膜的H+的个数为0.2NA,故D正确;
故选:D.
点评 本题涉及原电池的工作原理以及应用的考查,注意把握原电池中电极的判断和电极方程式的书写方法,侧重于学生的分析能力的考查,注意知识的迁移和应用是解题的关键,难度中等.

练习册系列答案
相关题目
15.NiCl2是化工合成中最重要的镍源,工业上以金属镍废料为原料生产NiCl2继而生产Ni2O3的工艺流程如下:

如表,列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③增大盐酸的浓度(或将镍废料研成粉末等)等.
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等.沉镍前需加Na2CO3控制溶液pH范围为4.7~7.1.
(3)从滤液A中可回收利用的主要物质是NaCl.
(4)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.
(5)工业上用镍为阳极,电解0.05~0.1mol•L-1NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉.当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图2所示:
①NH4Cl的浓度最好控制为10 g•L-1.
②当NH4Cl浓度大于15g•L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:2H++2e-=H2↑(或2NH4++2H2O+2e-=H2↑+2NH3•H2O).

如表,列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等.沉镍前需加Na2CO3控制溶液pH范围为4.7~7.1.
(3)从滤液A中可回收利用的主要物质是NaCl.
(4)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.
(5)工业上用镍为阳极,电解0.05~0.1mol•L-1NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉.当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图2所示:
①NH4Cl的浓度最好控制为10 g•L-1.
②当NH4Cl浓度大于15g•L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:2H++2e-=H2↑(或2NH4++2H2O+2e-=H2↑+2NH3•H2O).
9.吸热反应一定是( )
| A. | 释放能量 | |
| B. | 储存能量 | |
| C. | 反应物的总能量低于生成物的总能量 | |
| D. | 反应物的总能量高于生成物的总能量 |
16.下列实验的有关叙述不正确的是( )
| 选项 | A | B | C | D |
| 实验 装置 图 |  |  | 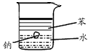 | 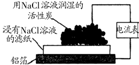 |
| 主要 现象 | 乙装置中有光亮通路,甲装置无明显现象 | 两试管中都有气泡产生,但乙比甲速率快 | 钠在水与苯层之间上下跳动,且有气泡产生 | 电流表指针发生偏转 |
| 实验 结论 | 乙装置中分散系为胶体,甲装置中分散系不是胶体 | 可验证FeCl3对H2O2分解反应有催化作用 | 证明密度ρ(苯)<ρ(钠)<ρ(水) | 电子从铝箔流出,经电流表、流到活性炭 |
| A. | A | B. | B | C. | C | D. | D |
13.下列说法中不正确的是( )
| A. | 正戊烷、新戊烷、异戊烷互为同分异构体 | |
| B. | 扁桃酸( )属于甲酸酯且有羟基直接连在苯环上的同分异构体共有13种 )属于甲酸酯且有羟基直接连在苯环上的同分异构体共有13种 | |
| C. |  互为同系物 互为同系物 | |
| D. | 四氯乙烯分子中所有原子都处于同一平面 |
14.下列实验操作能达到预期实验目的是( )
| 实验目的 | 实验操作 | |
| A | 验证淀粉已水解 | 在淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的银氨溶液并水浴加热 |
| B | 比较醋酸和次氯酸的酸性强弱 | 用PH试纸测定0.1mol•L-1醋酸钠溶液和0.01mol•L-1次氯酸钠溶液的PH |
| C | 证明Cl2的氧化性比Br2氧化性强 | 0.1mol•L-1 NaBr溶液中加入适量的新制氯水,反应后再加入适量的四氯化碳,振荡,观察下层液体的颜色 |
| D | 除去苯中混有的少量苯酚 | 向其中加入适量的溴水再过滤 |
| A. | A | B. | B | C. | C | D. | D |