题目内容
6.下列叙述中错误的是( )| A. | 通式CnH2n+2 只表示一类物质 | |
| B. | C3H8光照下与氯气反应,最多能生成四种二氯代烃 | |
| C. | 戊烷有3种同分异构体 | |
| D. | 甲苯一氯取代物有3种 |
分析 A.CnH2n+2中H原子达到饱和,一定为烷烃;
B.先确定丙烷的一氯代物种类,然后用氯原子分别再取代1个H较为二氯丙烷;
C.戊烷存在正戊烷、异戊烷和新戊烷3种同分异构体;
D.“等效氢”原子的种类决定一氯代物的种类,甲苯分子中含有4种等效H.
解答 解:A.CnH2n+2表示的只能为烷烃这一类物质,故A正确;
B.C3H8为丙烷,丙烷不存在同分异构体,二氯丙烷中两个氯原子在同一C原子上有2种,在不同C原子上也有2种,所以二氯丙烷有4种结构,故B正确;
C.戊烷的同分异构体有: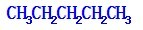 、
、 、
、 ,总共有3种结构,故C正确;
,总共有3种结构,故C正确;
D.甲苯中苯环上有邻间对三种一氯代物,甲基上氢还可被氯取代,故有4种一氯代物,故D错误;
故选C.
点评 本题考查了同分异构体、同系物的判断,题目难度不大,明确同分异构体的书写原则为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
3.下列有关的说法正确的是( )
| A. | 用活性炭除去冰箱中的异味是发生了化学反应 | |
| B. | 航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成,它是一种新型无机非金属材料 | |
| C. | 碘是人体必需微量元素,所以要多吃富含碘化钾的食物 | |
| D. | 可以利用氯化铁溶液的酸性清除铜镜表面的铜锈 |
4.下列实验方案适用于在实验室制取所需SO2的是( )
| A. | Na2SO3溶液与HNO3 | B. | Na2SO3固体与浓硫酸 | ||
| C. | 固体硫在纯氧中燃烧 | D. | 碳与热浓H2SO4 |
1.从2011年3月16日下午开始,大陆“海水受日本核辐射污染,碘可防辐射”等消息疯传,从浙江沿海地区开始出现抢盐潮,接着蔓延到多个城市,人们抢购加碘盐是因为食盐中添加了碘元素.

Ⅰ.人们在即将受到核辐射前的24小时内,需在医生指导下服用碘片,成人推荐服用量为100mg碘,假设此碘盐碘元素含量为50mg/kg,要达到上述碘含量要求,需服用该碘盐2kg,你觉得服用碘盐防辐射合理吗?不合理
Ⅱ.如图1为某加碘盐标签的一部分.
已知:
①KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
②I2+2Na2S2O3═2NaI+Na2S4O6(无色)
某同学欲测定此加碘盐中碘元素的含量,进行以下实验:
步骤1:称取ag市售食盐,配成溶液,全部转移至锥形瓶中,加入适量新制KI溶液,滴入几滴稀硫酸,溶液变黄
色,再加入3滴淀粉溶液.
步骤2:取一支50.00mL碱式滴定管,用bmol•L-1的新制Na2S2O3溶液润洗2~3次后,装满溶液,调节液面高度至0刻度.
步骤3:开始滴定直至终点,重复操作2~3次,实验数据记录如下:
(1)第一次读数为24.00mL.
(2)滴定终点的判断方法溶液颜色恰好由蓝色变为无色且半分钟内不褪色.
(3)经过计算此加碘盐碘元素的含量为$\frac{508000b}{a}$mg/kg(用包含a、b的最简表达式表示).
(4)下列操作可能会导致测量结果偏高的是CD.
A.步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5g
B.步骤1所配食盐溶液未完全转移至锥形瓶
C.步骤2中滴定管洗涤后未润洗
D.步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失.

Ⅰ.人们在即将受到核辐射前的24小时内,需在医生指导下服用碘片,成人推荐服用量为100mg碘,假设此碘盐碘元素含量为50mg/kg,要达到上述碘含量要求,需服用该碘盐2kg,你觉得服用碘盐防辐射合理吗?不合理
Ⅱ.如图1为某加碘盐标签的一部分.
已知:
①KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
②I2+2Na2S2O3═2NaI+Na2S4O6(无色)
某同学欲测定此加碘盐中碘元素的含量,进行以下实验:
步骤1:称取ag市售食盐,配成溶液,全部转移至锥形瓶中,加入适量新制KI溶液,滴入几滴稀硫酸,溶液变黄
色,再加入3滴淀粉溶液.
步骤2:取一支50.00mL碱式滴定管,用bmol•L-1的新制Na2S2O3溶液润洗2~3次后,装满溶液,调节液面高度至0刻度.
步骤3:开始滴定直至终点,重复操作2~3次,实验数据记录如下:
| 编号 | 碱式滴定管读数 | 消耗体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 0 | 如图一 | |
| 2 | 0 | 23.97 | 23.97 |
| 3 | 0 | 24.03 | 24.03 |
(2)滴定终点的判断方法溶液颜色恰好由蓝色变为无色且半分钟内不褪色.
(3)经过计算此加碘盐碘元素的含量为$\frac{508000b}{a}$mg/kg(用包含a、b的最简表达式表示).
(4)下列操作可能会导致测量结果偏高的是CD.
A.步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5g
B.步骤1所配食盐溶液未完全转移至锥形瓶
C.步骤2中滴定管洗涤后未润洗
D.步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失.
11.化学与人类生产、生活密切相关,下列说法正确的是( )
| A. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| B. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 | |
| C. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| D. | 用含有橙色的酸性重铬酸钾的仪器检验酒后驾车,利用了乙醇的氧化性 |
18.NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 100mL 12mol•L-1盐酸溶液与足量MnO2共热,反应生成的气体分子数为0.3NA | |
| B. | 密闭反应容器中充入2mol SO2和1mol O2,充分反应转移电子数为4NA | |
| C. | 25.0g胆矾晶体溶于水配成1L溶液,所得溶液中阳离子数为0.1NA | |
| D. | 常温常压下,0.1mol C5H12所含有的共价键数目为1.6NA |
15.NiCl2是化工合成中最重要的镍源,工业上以金属镍废料为原料生产NiCl2继而生产Ni2O3的工艺流程如下:

如表,列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③增大盐酸的浓度(或将镍废料研成粉末等)等.
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等.沉镍前需加Na2CO3控制溶液pH范围为4.7~7.1.
(3)从滤液A中可回收利用的主要物质是NaCl.
(4)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.
(5)工业上用镍为阳极,电解0.05~0.1mol•L-1NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉.当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图2所示:
①NH4Cl的浓度最好控制为10 g•L-1.
②当NH4Cl浓度大于15g•L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:2H++2e-=H2↑(或2NH4++2H2O+2e-=H2↑+2NH3•H2O).

如表,列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等.沉镍前需加Na2CO3控制溶液pH范围为4.7~7.1.
(3)从滤液A中可回收利用的主要物质是NaCl.
(4)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.
(5)工业上用镍为阳极,电解0.05~0.1mol•L-1NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉.当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图2所示:
①NH4Cl的浓度最好控制为10 g•L-1.
②当NH4Cl浓度大于15g•L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:2H++2e-=H2↑(或2NH4++2H2O+2e-=H2↑+2NH3•H2O).
16.下列实验的有关叙述不正确的是( )
| 选项 | A | B | C | D |
| 实验 装置 图 | 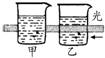 |  | 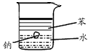 | 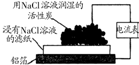 |
| 主要 现象 | 乙装置中有光亮通路,甲装置无明显现象 | 两试管中都有气泡产生,但乙比甲速率快 | 钠在水与苯层之间上下跳动,且有气泡产生 | 电流表指针发生偏转 |
| 实验 结论 | 乙装置中分散系为胶体,甲装置中分散系不是胶体 | 可验证FeCl3对H2O2分解反应有催化作用 | 证明密度ρ(苯)<ρ(钠)<ρ(水) | 电子从铝箔流出,经电流表、流到活性炭 |
| A. | A | B. | B | C. | C | D. | D |