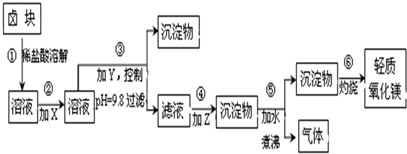
题目内容
X、Y、Z、W是原子序数依次增大的前四周期常见的元素,其相关信息如下表:
(1)W位于元素周期表第 周期第 族,其基态原子最外层有 个电子.
(2)X的电负性比Y的 (填“大”或“小”);X和Y的气态氢化物中,较稳定的是 (写化学式).
(3)Z元素形成简单离子的离子结构示意图 .
(4)XY2由固态变为气态所需克服的微粒间作用力是 ;氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称 .
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(2)X的电负性比Y的
(3)Z元素形成简单离子的离子结构示意图
(4)XY2由固态变为气态所需克服的微粒间作用力是
考点:位置结构性质的相互关系应用
专题:
分析:X、Y、Z、W是原子序数依次增大的前四周期常见的元素,X的基态原子L层电子数是K层电子数的2倍,则X为碳元素,Y是地壳中含量最高的元素,则Y为氧元素,Z的基态原子最外层电子排布式为3s23p1,则Z为铝元素,W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色,则W为铁元素,据此答题.
解答:
解:X、Y、Z、W是原子序数依次增大的前四周期常见的元素,X的基态原子L层电子数是K层电子数的2倍,则X为碳元素,Y是地壳中含量最高的元素,则Y为氧元素,Z的基态原子最外层电子排布式为3s23p1,则Z为铝元素,W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色,则W为铁元素,
(1)W为铁元素,位于元素周期表第四周期第Ⅷ族,其基态原子最外层有2个电子,
故答案为:四;Ⅷ;2;
(2)X为碳元素,Y为氧元素,根据元素周期律,碳的电负性比氧的小,非金属性越弱,氢化物稳定性越差,由于碳的非金属性弱于氧,所以碳和氧的气态氢化物中,较稳定的是 H2O,故答案为:小;H2O;
(3)Z为铝元素,铝离子的离子结构示意图为 ,故答案为:
,故答案为: ;
;
(4)XY2为二氧化碳,是分子晶体,所以由固态变为气态所需克服的微粒间作用力是范德华力,H、C、O的原子形成同种分子间氢键的物质为乙酸,
故答案为:范德华力;乙酸.
(1)W为铁元素,位于元素周期表第四周期第Ⅷ族,其基态原子最外层有2个电子,
故答案为:四;Ⅷ;2;
(2)X为碳元素,Y为氧元素,根据元素周期律,碳的电负性比氧的小,非金属性越弱,氢化物稳定性越差,由于碳的非金属性弱于氧,所以碳和氧的气态氢化物中,较稳定的是 H2O,故答案为:小;H2O;
(3)Z为铝元素,铝离子的离子结构示意图为
 ,故答案为:
,故答案为: ;
;(4)XY2为二氧化碳,是分子晶体,所以由固态变为气态所需克服的微粒间作用力是范德华力,H、C、O的原子形成同种分子间氢键的物质为乙酸,
故答案为:范德华力;乙酸.
点评:本题主要考查了元素周期表和元素周期律、原子结构示意图、分子间作用力等知识点,难度不大,解题时注意根据原子结构及元素的性质确定元素种类.

练习册系列答案
相关题目
下列各组离子能大量共存于同一溶液中,且加入过量NaOH溶液或少量稀H2SO4时,都能产生白色沉淀的是( )
| A、Ba2+、Mg2+、NO3-、CO32+ |
| B、Na+、Al3+、Cl-、Mg2+ |
| C、K+、Ba2+、Cl-、HCO3- |
| D、NH4+、Ba2+、Fe3+、Cl- |
用自来水养金鱼之前,一般要把水放在阳光下曝晒一段时间.其目的是( )
| A、除去次氯酸 |
| B、提高水温 |
| C、增加水中氧气的含量 |
| D、利用紫外线杀菌 |
关于电解质和非电解质的说法中正确的是( )
| A、电解质一定能导电 |
| B、某物质不是电解质就是非电解质 |
| C、非电解质在水溶液中也可能会发生电离 |
| D、强电解质在水溶液中完全以离子形式存在 |
对于白磷引起的中毒,硫酸铜溶液是一种解毒剂,有关反应如下:11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4下列关于该反应的说法正确的是( )
| A、CuSO4发生了氧化反应 |
| B、生成1 mol H3PO4时,有10 mol 电子转移 |
| C、白磷只作还原剂 |
| D、氧化产物和还原产物的物质的量之比为6:5 |
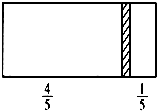 在一个密闭容器中,中间有一可自由滑动的隔板,将容器分成两部分.当左边充入1molN2,右边充入8gCO和CO2的混合气体时,隔板处于如图所示位置(两侧温度相同).则混合气体中CO和CO2的分子个数比为( )
在一个密闭容器中,中间有一可自由滑动的隔板,将容器分成两部分.当左边充入1molN2,右边充入8gCO和CO2的混合气体时,隔板处于如图所示位置(两侧温度相同).则混合气体中CO和CO2的分子个数比为( )