题目内容
某结晶水合物的化学式为R?nH2O,其式量为M.25℃时,将ag该晶体溶于bg水中可形成VmL饱和溶液.下列关系中正确的是( )
A、饱和溶液的物质的量浓度为c=
| ||
B、25℃时R的溶解度为S=
| ||
C、饱和溶液中溶质的质量分数为W=
| ||
D、饱和溶液的密度为ρ=
|
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:A.根据n=
计算R?nH2O的物质的量,而n(R)=n(R?nH2O),根据c=
计算该饱和溶液的物质的量浓度;
B.根据化学式计算结晶水的质量、R的质量,进而计算溶液中水的总质量,计算100g溶解R的质量即为溶解度;
C.根据w(溶质)=
×100%计算该饱和溶液质量分数;
D.溶液总质量为(a+b)g,根据ρ=
计算溶液密度,或利用c=
进行公示变形计算.
| m |
| M |
| n |
| V |
B.根据化学式计算结晶水的质量、R的质量,进而计算溶液中水的总质量,计算100g溶解R的质量即为溶解度;
C.根据w(溶质)=
| m(溶质) |
| m(溶液) |
D.溶液总质量为(a+b)g,根据ρ=
| m |
| V |
| 1000ρω |
| M |
解答:
解:A.n(R)=n(R?nH2O)=
mol,该饱和溶液的物质的量浓度
=
mol/L,故A错误;
B.R的质量为
×ag,结晶水的质量为
×ag,则100g:S=(
×ag+bg):
×ag,解得S=
g,故B错误;
C.根据w(溶质)=
×100%,可知该饱和溶液质量分数为
×100%=
%,故C正确;
D.溶液总质量为(a+b)g,根据ρ=
可知,溶液密度为
=
g/mol,利用c=
可知,密度ρ=
=
×M÷(1000×
%)g/mL=
g/mL,故D错误,
故选C.
| a |
| M |
| ||
| V×10-3L |
| 1000a |
| MV |
B.R的质量为
| M-18n |
| M |
| 18n |
| M |
| 18n |
| M |
| M-18n |
| M |
| 100a(M-18n) |
| 18na+bM |
C.根据w(溶质)=
| m(溶质) |
| m(溶液) |
| ||
| ag+bg |
| 100a(M-18n) |
| M(a+b) |
D.溶液总质量为(a+b)g,根据ρ=
| m |
| V |
| (a+b)g |
| VmL |
| a+b |
| V |
| 1000ρω |
| M |
| cM |
| 1000ω |
| 1000a |
| MV |
| 100a(M-18n) |
| M(a+b) |
| M(a+b) |
| V(M-18n) |
故选C.
点评:本题考查溶液浓度计算,涉及物质的量浓度、质量分数、溶解度,属于字母型计算,为易错题目,注意对基础知识的理解掌握.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
下列各组离子能大量共存于同一溶液中,且加入过量NaOH溶液或少量稀H2SO4时,都能产生白色沉淀的是( )
| A、Ba2+、Mg2+、NO3-、CO32+ |
| B、Na+、Al3+、Cl-、Mg2+ |
| C、K+、Ba2+、Cl-、HCO3- |
| D、NH4+、Ba2+、Fe3+、Cl- |
关于电解质和非电解质的说法中正确的是( )
| A、电解质一定能导电 |
| B、某物质不是电解质就是非电解质 |
| C、非电解质在水溶液中也可能会发生电离 |
| D、强电解质在水溶液中完全以离子形式存在 |
对于白磷引起的中毒,硫酸铜溶液是一种解毒剂,有关反应如下:11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4下列关于该反应的说法正确的是( )
| A、CuSO4发生了氧化反应 |
| B、生成1 mol H3PO4时,有10 mol 电子转移 |
| C、白磷只作还原剂 |
| D、氧化产物和还原产物的物质的量之比为6:5 |
20g密度为dg/cm3的硝酸钙溶液中,含有1gCa2+离子,则NO3-离子的物质的量浓度为( )
A、
| ||
B、
| ||
| C、2.5dmol/L | ||
| D、1.25dmol/L |
下列表示对应化学反应的离子方程式正确的是( )
A、电解饱和NaCl溶液:2Cl-+2H+
| ||||
| B、向Na2SO3溶液中滴加足量NaClO溶液:SO32-+ClO-=SO42-+Cl- | ||||
| C、向FeBr2溶液中通入足量Cl2:2Fe2++Cl2=2Fe3++2Cl- | ||||
| D、向Ca(OH)2溶液中加少量NaHCO3溶液:2 HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:

下列推断不合理的是( )

下列推断不合理的是( )
| A、生成1mol (NH4)2SO4至少消耗2mol NH3 |
| B、CO2可被循环使用 |
| C、先通二氧化碳,后通氨气,效果相同 |
| D、往甲中通CO2有利于制备(NH4)2SO4 |
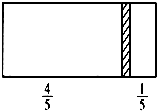 在一个密闭容器中,中间有一可自由滑动的隔板,将容器分成两部分.当左边充入1molN2,右边充入8gCO和CO2的混合气体时,隔板处于如图所示位置(两侧温度相同).则混合气体中CO和CO2的分子个数比为( )
在一个密闭容器中,中间有一可自由滑动的隔板,将容器分成两部分.当左边充入1molN2,右边充入8gCO和CO2的混合气体时,隔板处于如图所示位置(两侧温度相同).则混合气体中CO和CO2的分子个数比为( )| A、1:1 | B、1:3 |
| C、2:1 | D、3:1 |
X、Y、M、N是短周期主族元素,且原子序数依次增大.已知X的最外层电子数是电子层数的3倍,X、M同主族,Y的原子在短周期主族元素中原子半径最大.下列说法正确的是( )
| A、M与X形成的化合物对应的水化物一定是强酸 |
| B、Y2X和Y2X2中阴、阳离子的个数比相同,化学键类型也完全相同 |
| C、X、Y的简单离子半径:r(X2-)>r(Y+) |
| D、M的气态氢化物比N的气态氢化物稳定 |