题目内容
13.下列化学用语表达正确的是( )| A. | 乙烯的结构简式:C2H4 | B. | 甲烷分子的球棍模型: | ||
| C. | NaCl的电子式: | D. | 氟离子的结构示意图: |
分析 A、乙烯的结构简式中碳碳双键不能省略;
B、球棍模型是用小球和小棍表示物质的构成的模型;
C、氯化钠是离子化合物;
D、氟离子核内有9个质子,核外有10个电子,画出其结构示意图即可.
解答 解:A、乙烯的结构简式中碳碳双键不能省略,即乙烯的结构简式为:CH2=CH2,故A错误;
B、甲烷为正四面体结构,分子中含有4个碳氢键,甲烷正确的球棍模型为: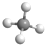 ,故B正确;
,故B正确;
C、氯化钠是离子化合物,钠离子和氯离子之间通过离子键形成化合物,故电子式为 ,故C错误;
,故C错误;
D、氟离子核内有9个质子,核外有10个电子,氟离子的结构示意图为  ,故D错误.
,故D错误.
故选B.
点评 本题考查了常用的化学用语,难度不大,注意原子形成阴离子时电子层数不变,但电子数增多.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
4.下列说法正确的是( )
| A. | 滴有酚酞的Na2CO3溶液中加入BaCl2溶液,红色褪去可证明BaCl2溶液显酸性 | |
| B. | 根据盐溶液的酸碱性,将盐分成酸式盐、正盐和碱式盐 | |
| C. | 泡沫灭火器是利用硫酸铝溶液和碳酸钠溶液反应产生大量CO2和Al(OH)3灭火 | |
| D. | NH4F溶液中含有少量的HF,因此NH4F溶液不能存放于玻璃试剂瓶中 |
8.Na2CO3+CO2+H2O═2NaHCO3的反应类型是( )
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
18.下列说法不正确的是( )
| A. | 乙烯能使酸性高锰酸钾溶液褪色,是因为乙烯分子中含有碳碳双键 | |
| B. | 苯可以使溴水褪色,是发生了加成反应 | |
| C. | 乙醛在一定条件下与氧气反应生成乙酸,乙醛发生了氧化反应 | |
| D. | 氨基酸分子中均含有羧基(-COOH)和氨基(-NH2) |
5.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 分子数为NA的CO和C2H4混合气体的体积约为22.4 L | |
| B. | 标准状况下,4.48 L重水(D2O)中含有的中子数为2NA | |
| C. | 用MnO2与浓盐酸制取Cl2时,每生成0.5mol Cl2则转移电子数为NA | |
| D. | 0.1 L 3.0 mol•L-1的NH4NO3溶液中含有NH${\;}_{4}^{+}$的数目为0.3NA |
2.现有20gD2O和36gH2O,下列说法不正确的是( )
| A. | 它们的分子数之比为1:2 | |
| B. | 它们的中子数之比为5:8 | |
| C. | 它们的电子数之比为1:2 | |
| D. | 分别与1mol钠反应,生成气体的质量比为1:1 |
20.在由水电离出的c(H+)水•c(OH-)水=10-24的溶液中一定大量共存的离子组是( )
| A. | Fe2+、Na+、NO3-、Cl- | B. | Ba2+、Na+、NO3-、Cl- | ||
| C. | SO42-、SO32-、NH4+、Na+ | D. | Mg2+、Na+、Br-、AlO2- |
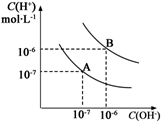 水的电离平衡曲线如图所示:
水的电离平衡曲线如图所示: