题目内容
16. 实验室常用如图所示的简易装置进行NO气体的制备和收集
实验室常用如图所示的简易装置进行NO气体的制备和收集①写出铜与稀硝酸反应的化学方程式3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.
②铜与稀硝酸反应开始时先慢后快的主要原因是反应放出的热量使溶液的温度升高,加快反应的速率.
分析 ①Cu与稀硝酸反应生成硝酸铜、NO和水;
②该反应放热,温度升高,可加快反应速率.
解答 解:①铜与稀硝酸反应的化学方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,故答案为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
②铜与稀硝酸反应开始时先慢后快的主要原因是反应放出的热量使溶液的温度升高,加快反应的速率,故答案为:反应放出的热量使溶液的温度升高,加快反应的速率.
点评 本题考查硝酸的性质实验,为高频考点,把握物质的性质、发生的反应及实验技能为解答的关键,侧重分析与实验能力的考查,注意温度影响反应速率,题目难度不大.

练习册系列答案
 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
6.汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO.为了减轻大气污染科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,即 2NO+2CO?2CO2+N2.
为了测定在某种催化剂作用下该反应的反应速率,t1℃下,在一等容的密闭容器中,用气体传感器测得了不同时间的NO和CO的浓度如表(CO2和N2的起始浓度为0).
回答下列问题:
(1)已知在上述反应中,反应物总能量大于生成物总能量,则正反应是放热反应(填“放热”或“吸热”).
(2)前3s内的平均反应速率:υ(N2)=1.42×10-4mol/(L•s).
(3)t1℃时该反应的平衡常数表达式:K=$\frac{{c}^{2}(C{O}_{2})×c({N}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$.
(4)假设在密闭容器中该反应达到平衡后,改变下列条件,能提高NO转化率的是cd(选填答案编号).
a.选用更有效的催化剂 b.升高反应体系的温度
c.降低反应体系的温度 d.缩小容器的体积.
为了测定在某种催化剂作用下该反应的反应速率,t1℃下,在一等容的密闭容器中,用气体传感器测得了不同时间的NO和CO的浓度如表(CO2和N2的起始浓度为0).
| 时间 (s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (×10-4,mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO) (×10-3,mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
(1)已知在上述反应中,反应物总能量大于生成物总能量,则正反应是放热反应(填“放热”或“吸热”).
(2)前3s内的平均反应速率:υ(N2)=1.42×10-4mol/(L•s).
(3)t1℃时该反应的平衡常数表达式:K=$\frac{{c}^{2}(C{O}_{2})×c({N}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$.
(4)假设在密闭容器中该反应达到平衡后,改变下列条件,能提高NO转化率的是cd(选填答案编号).
a.选用更有效的催化剂 b.升高反应体系的温度
c.降低反应体系的温度 d.缩小容器的体积.
4.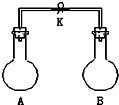 如图所示,室温下,A、B两个容积相等的烧瓶中分别集满了两种气体(同温、同压),当取下K夹,使两烧瓶内气体充分接触后,容器内压强由小到大的顺序正确的是( )
如图所示,室温下,A、B两个容积相等的烧瓶中分别集满了两种气体(同温、同压),当取下K夹,使两烧瓶内气体充分接触后,容器内压强由小到大的顺序正确的是( )
 如图所示,室温下,A、B两个容积相等的烧瓶中分别集满了两种气体(同温、同压),当取下K夹,使两烧瓶内气体充分接触后,容器内压强由小到大的顺序正确的是( )
如图所示,室温下,A、B两个容积相等的烧瓶中分别集满了两种气体(同温、同压),当取下K夹,使两烧瓶内气体充分接触后,容器内压强由小到大的顺序正确的是( )| 编 号 | ① | ② | ③ | ④ |
| A中气体 | H2S | H2 | NH3 | NO |
| B中气体 | SO2 | Cl2 | HCl | O2 |
| A. | ②③④① | B. | ③①④② | C. | ③②①④ | D. | ④③②① |
11.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1molFeCl3与沸水反应生成的胶体中含有NA个Fe(OH)3胶粒 | |
| B. | 1.12LNH3所含的原子数是0.2NA | |
| C. | 常温常压下,0.4molNa2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA | |
| D. | 1molNa2O2晶体中共含有4NA个离子 |
1.城市饮用水的消毒剂有多种,液氯、漂白粉、二氧化氯、臭氧等,臭氧作为一种理想的消毒剂,杀菌能力强且不会影响水质,这是利用了臭氧的( )
| A. | 强还原性 | B. | 强氧化性 | C. | 助燃性 | D. | 不稳定性 |
8.下列物质中,属于同素异形体的是( )
| A. | O2和O3 | B. | CO和CO2 | C. | 12C和13C | D. | H2O和H2O2 |
5.下列各组在溶液中进行的两个反应,可用同一离子方程式表示的是( )
| A. | CaCO3和HCl;Na2CO3和HCl | B. | BaCl2 和H2SO4;Ba(OH)2和H2SO4 | ||
| C. | HCl 和Na2CO3;HCl和NaHCO3 | D. | KOH 和H2SO4;Ba(OH)2和HNO3 |
6.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 10gT2O含有的电子数为5NA | |
| B. | 常温下,0.2L 0.5mol•L-1NH4NO3溶液的氮原子数小于0.2NA | |
| C. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.4NA | |
| D. | 常温常压下,5.6gC2H4和C3H6的混合气体中含氢原子数为0.9NA |