题目内容
4. 在元素周期表中所示氮元素如图.化学家在研究人工固氮的过程中使用了N3-,下列对于N3-的说法中不正确的是( )
在元素周期表中所示氮元素如图.化学家在研究人工固氮的过程中使用了N3-,下列对于N3-的说法中不正确的是( )| A. | N3-是氮元素的一种新单质 | B. | N3-是带1个单位负电荷的阴离子 | ||
| C. | N3-的相对质量约为42 | D. | 1个N3-中有21个质子和22个电子 |
分析 N3-是由3个氮原子构成的阴离子,离子中含有21个质子和22个电子,相对分子质量为42.
解答 解:A.N3-是氮元素的一种离子,不是新单质,故A错误;
B.N3-是带1个单位负电荷的阴离子,故B正确;
C.N3-的相对质量约为14×3=42,故C正确;
D.1个N3-中有21个质子和22个电子,故D正确.
故选A.
点评 本题考查物质的构成微粒中的质子数与电子数的关系,注意阴离子中质子数与电子数的关系来解答.

练习册系列答案
相关题目
15.常温下,A溶液的PH=6,B溶液的[OH-]=10-10mol/L,C溶液的[H+]=10-1mol/L,三种溶液的酸性由强到弱的顺序是( )
| A. | ABC | B. | CBA | C. | BCA | D. | BAC |
12.下列事实不能用键能的大小来解释的是( )
| A. | N元素的电负性较大,但N2的化学性质很稳定 | |
| B. | 稀有气体一般难发生反应 | |
| C. | HF、HCl、HBr、HI的稳定性逐渐减弱 | |
| D. | F2比O2更容易与H2反应 |
16.下列推断性结论中正确的是( )
| A. | 第2周期元素氢化物的稳定性顺序是HF>H2O>NH3;则第3周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 | |
| B. | ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 | |
| C. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,必有阴离子 | |
| D. | I-I键的键能比F-F、Cl-Cl、Br-Br键的键能都小;则在卤素单质中碘的熔点最低 |
13.下列物质中属于电解质且能导电的是( )
| A. | 稀盐酸 | B. | 硫酸铜溶液 | C. | 酒精 | D. | 氯化钠(熔融) |
14.化学与生活密切相关,下列说法正确的是( )
| A. | 变性蛋白质不能食用 | |
| B. | 可用甲醛浸泡海鲜 | |
| C. | SO2可以用来增白食品 | |
| D. | “地沟油”禁止食用,但可以用来制肥皂 |
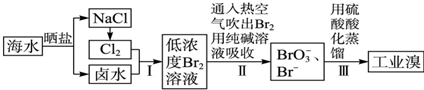
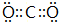 ,E的电子式
,E的电子式 ,其中E含有非极性共价键(填“离子键”、“极性共价键”或“非极性共价键”)
,其中E含有非极性共价键(填“离子键”、“极性共价键”或“非极性共价键”) A、B、C、D、E五种短周期元素,原子序数E>D>A>B>C,且A、B、D、E同周期,A、C同主族,A的原子结构示意图如图,B的最外层电子数比K层电子多1,D元素的主族序数是周期序数的2倍,E的单质是黄绿色气体;据此填空:
A、B、C、D、E五种短周期元素,原子序数E>D>A>B>C,且A、B、D、E同周期,A、C同主族,A的原子结构示意图如图,B的最外层电子数比K层电子多1,D元素的主族序数是周期序数的2倍,E的单质是黄绿色气体;据此填空: