题目内容
13.下列物质中属于电解质且能导电的是( )| A. | 稀盐酸 | B. | 硫酸铜溶液 | C. | 酒精 | D. | 氯化钠(熔融) |
分析 电解质是在水溶液中或溶质状态下能导电的化合物,而物质要想导电,要么有自由移动的电子,要么有自由移动的离子,据此分析.
解答 解:A、稀盐酸是混合物,故不是电解质,故A错误;
B、硫酸铜溶液是混合物,故不是电解质,故B错误;
C、酒精在水溶液中和熔融状态下均不能导电,故为非电解质,故C错误;
D、氯化钠在水溶液中或熔融状态下均能导电,故为电解质,且熔融的氯化钠中有自由移动的离子,故能导电,故D正确.
故选D.
点评 本题考查了电解质、非电解质的概念和物质导电的判断,应注意的是电解质不一定能导电,能导电的不一定是电解质.

练习册系列答案
相关题目
3.某碱金属1.15g与足量水反应,得到标准状况下0.56L氢气,则该金属是( )
| A. | Li | B. | Na | C. | K | D. | Rb |
4. 在元素周期表中所示氮元素如图.化学家在研究人工固氮的过程中使用了N3-,下列对于N3-的说法中不正确的是( )
在元素周期表中所示氮元素如图.化学家在研究人工固氮的过程中使用了N3-,下列对于N3-的说法中不正确的是( )
 在元素周期表中所示氮元素如图.化学家在研究人工固氮的过程中使用了N3-,下列对于N3-的说法中不正确的是( )
在元素周期表中所示氮元素如图.化学家在研究人工固氮的过程中使用了N3-,下列对于N3-的说法中不正确的是( )| A. | N3-是氮元素的一种新单质 | B. | N3-是带1个单位负电荷的阴离子 | ||
| C. | N3-的相对质量约为42 | D. | 1个N3-中有21个质子和22个电子 |
1.下列反应属于吸热反应的是( )
| A. | 碳在氧气中的燃烧 | B. | 葡萄糖在人体内氧化分解 | ||
| C. | Ba(OH)2•8H2O与NH4Cl反应 | D. | 锌粒与稀H2SO4反应制取H2 |
8.下列说法正确的是( )
| A. | 丙烷的比例模型是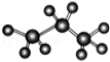 | |
| B. | C2H4 与C3H6一定互为同系物 | |
| C. | 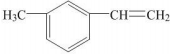 属于芳香烃 属于芳香烃 | |
| D. | 羟基的电子式为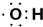 ,1 mol-OH 含有7 mol 电子 ,1 mol-OH 含有7 mol 电子 |
18.同温同压下,决定气体体积大小的主要原因是( )
| A. | 气体分子的大小 | B. | 气体的物质的量 | ||
| C. | 气体分子间的平均距离 | D. | 气体分子的运动速度 |
5.相同体积的某营养液两份,其配方如下表:
比较两份营养液中各种离子的浓度,下列有关说法正确的是( )
| KCl | K2SO4 | ZnSO4 | ZnCl2 | |
| (1) | 0.3mol | 0.2mol | 0.1mol | ╱ |
| (2) | 0.1mol | 0.3mol | ╱ | 0.1mol |
| A. | 各种离子的浓度均相同 | B. | 只有c(K+)相同 | ||
| C. | 各种离子的浓度均不同 | D. | 只有c(Zn2+)相同 |
2.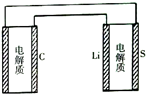 已知:锂离子电池的总反应为:LixC+Li1-xCoO2$?_{充电}^{放电}$C+LiCoO2锂硫电池的总反应为:2Li+S$?_{充电}^{放电}$Li2S有关上述两种电池说法正确的是( )
已知:锂离子电池的总反应为:LixC+Li1-xCoO2$?_{充电}^{放电}$C+LiCoO2锂硫电池的总反应为:2Li+S$?_{充电}^{放电}$Li2S有关上述两种电池说法正确的是( )
 已知:锂离子电池的总反应为:LixC+Li1-xCoO2$?_{充电}^{放电}$C+LiCoO2锂硫电池的总反应为:2Li+S$?_{充电}^{放电}$Li2S有关上述两种电池说法正确的是( )
已知:锂离子电池的总反应为:LixC+Li1-xCoO2$?_{充电}^{放电}$C+LiCoO2锂硫电池的总反应为:2Li+S$?_{充电}^{放电}$Li2S有关上述两种电池说法正确的是( )| A. | 锂离子电池放电时,Li+向负极迁移 | |
| B. | 锂离子电池放电时,负极反应为:6C+xLi++xe-═LixC6 | |
| C. | 理论上两种电池的比能量相同 | |
| D. | 如图表示用锂硫电池给锂离子电池充电 |