题目内容
下列说法不正确的是( )
| A、放热反应不需加热即可发生 |
| B、化学反应均伴随有能量变化,这种能量变化除热能外,还可以是光能、电能等 |
| C、可燃物的燃烧热的大小与参与反应的可燃物的多少无关 |
| D、化学反应热效应数值与参与反应的物质多少有关 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A、反应放热还是吸热与反应条件无关;
B、化学反应过程是旧键断裂新键形成的过程,断键需要吸收能量,成键会释放能量;
C、燃烧热是指1mol可燃物燃烧释放的能量;
D、△H的大小与化学计量数有关.
B、化学反应过程是旧键断裂新键形成的过程,断键需要吸收能量,成键会释放能量;
C、燃烧热是指1mol可燃物燃烧释放的能量;
D、△H的大小与化学计量数有关.
解答:
解:A、可燃物燃烧都放热,需要加热到着火点,故A错误;
B、化学反应过程是旧键断裂新键形成的过程,断键需要吸收能量,成键会释放能量,所以,化学反应过程一定有能量变化,不一定是热能,还可以是光能、电能等等,故B正确;
C、燃烧热是指1mol可燃物燃烧释放的能量,与反应物多少无关,故C正确;
D、反应热是生成物能量和与反应物能量和的差值,与反应物多少有关,故D正确.
故选:A.
B、化学反应过程是旧键断裂新键形成的过程,断键需要吸收能量,成键会释放能量,所以,化学反应过程一定有能量变化,不一定是热能,还可以是光能、电能等等,故B正确;
C、燃烧热是指1mol可燃物燃烧释放的能量,与反应物多少无关,故C正确;
D、反应热是生成物能量和与反应物能量和的差值,与反应物多少有关,故D正确.
故选:A.
点评:题目考查了反应热的原因、求算以及反应热的能量变化形式,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 2013年12月2日1时30分,搭载着嫦娥三号的长征三号乙运载火箭在西昌卫星发射中心发射升空并准确入轨,发射圆满成功.火箭的一子级、助推器和二子级使用偏二甲肼[(CH3)2NNH2,结构如图所示]和N2O4作为推进剂,反应如下:(CH3)2NNH2+2N2O4═2CO2↑+4H2O↑+3N2↑,下列有关说法正确的是( )
2013年12月2日1时30分,搭载着嫦娥三号的长征三号乙运载火箭在西昌卫星发射中心发射升空并准确入轨,发射圆满成功.火箭的一子级、助推器和二子级使用偏二甲肼[(CH3)2NNH2,结构如图所示]和N2O4作为推进剂,反应如下:(CH3)2NNH2+2N2O4═2CO2↑+4H2O↑+3N2↑,下列有关说法正确的是( )| A、设NA为阿伏伽德罗常数的值,则46g NO2和N2O4的混合气体含有的氧原子数在2NA到4NA之间 |
| B、偏二甲肼分子中既含σ键又含π键 |
| C、(CH3)2NNH2和N2O4都属于分子晶体 |
| D、每反应1mol (CH3)2NNH2有44.8L N2O4被还原 |
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、2g H218O中含有NA个中子 |
| B、标准状况下,14g CO气体中含有的原子数为0.5NA |
| C、0.1mol NH3分子中含有0.9NA个电子 |
| D、2.24L CH4气体中所含原子数为0.5NA |
化学与生活、生产、环境等社会实际密切相关.下列叙述正确的是( )
| A、稀的食盐水能杀死H7N9禽流感病毒 |
| B、涤纶、塑料、光导纤维都是有机高分子材料 |
| C、用电镀厂的废水直接灌溉农田,可提高水的利用率 |
| D、外形似海绵、密度小、有磁性的碳与石墨互为同素异形体 |
关于下列实验的叙述中正确的是( )
| A、溴乙烷在浓硫酸作用下加热可制得乙烯. |
| B、在制备乙酸乙酯实验中,长导管有冷凝蒸汽和导气的作用,饱和碳酸钠溶液液面上有油状并有香味液体生成 |
| C、实验室可用无水乙醇和过量的3mol/L硫酸的混合液制乙烯 |
| D、用电石和水可制得纯净的乙炔 |
几种短周期元素的原子半径及主要化合价如下表
下列说法正确的是( )
| 元素代号 | L | M | X | R | T |
| 原子半径(nm) | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A、L、T形成的简单离子核外电子数相等 |
| B、R的氧化物对应的水化物呈强碱性 |
| C、X单质在氧气中燃烧生成XO3 |
| D、离子半径大小:r(M3+)>r(T2-) |
某同学设计如图元素周期表,以下说法正确的是( )
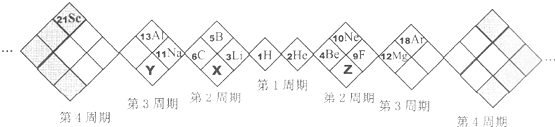

| A、X、Y、Z元素分别为N、P、O |
| B、白格中都是主族元素,灰格中都是副族元素 |
| C、原子半径:Z>X>Y |
| D、X、Y、Z的气态氢化物中最稳定的是:X的氢化物 |
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O
Cd(OH)2+2Ni(OH)2.有关该电池的说法正确的是( )
| 放电 |
| 充电 |
| A、放电时负极反应式为:NiOOH+H2O+e-═Ni(OH)2+OH- |
| B、放电过程电子从正极流向负极 |
| C、放电时溶液中正极附近OH-浓度变小 |
| D、充电时电解质溶液中的OH-向阳极移动 |