题目内容
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O
Cd(OH)2+2Ni(OH)2.有关该电池的说法正确的是( )
| 放电 |
| 充电 |
| A、放电时负极反应式为:NiOOH+H2O+e-═Ni(OH)2+OH- |
| B、放电过程电子从正极流向负极 |
| C、放电时溶液中正极附近OH-浓度变小 |
| D、充电时电解质溶液中的OH-向阳极移动 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:放电时负极上发生的电极反应式为:Cd-2e-+2OH-=Cd(OH)2,正极上发生的电极反应式为:NiOOH+e-+H2O═Ni(OH)2+OH-,充电时阳极上发生的电极反应式为:Ni(OH)2+OH--e-→NiOOH+H2O,阴极上发生的电极反应式为:Cd(OH)2+2e-═Cd+2OH-,放电时,溶液中氢氧根离子向负极移动,充电时该装置是电解池.
解答:
解:A.放电时,负极发生氧化反应,电极方程式为Cd-2e-+2OH-=Cd(OH)2,故A错误;
B.放电时电子从负极经导电流向正极,故B错误;
C.放电时正极反应为:NiOOH+e-+H2O═Ni(OH)2+OH-,OH-浓度增大,故C错误;
D.充电时,阴离子向阳极移动,阴离子向阴极移动,故D正确.
故选D.
B.放电时电子从负极经导电流向正极,故B错误;
C.放电时正极反应为:NiOOH+e-+H2O═Ni(OH)2+OH-,OH-浓度增大,故C错误;
D.充电时,阴离子向阳极移动,阴离子向阴极移动,故D正确.
故选D.
点评:本题考查原电池和电解池原理、电极反应式的书写,明确电极上得失电子及反应物质是解本题关键,电极反应式的书写是学习难点,要注意结合电解质溶液的酸碱性书写,难度中等.

练习册系列答案
相关题目
设NA为阿佛加德罗常数的数值,下列说法正确的是( )
| A、常温常压下,8g O2含有4NA个电子 |
| B、1L 0.1mol?L-1的氨水中有NA个NH4+ |
| C、常温常压下,22.4L氯气与足量的镁粉反应,转移的电子数为2NA |
| D、1mol Na在空气中燃烧失去2NA个电子 |
下列说法不正确的是( )
| A、放热反应不需加热即可发生 |
| B、化学反应均伴随有能量变化,这种能量变化除热能外,还可以是光能、电能等 |
| C、可燃物的燃烧热的大小与参与反应的可燃物的多少无关 |
| D、化学反应热效应数值与参与反应的物质多少有关 |
短周期元素的X、Y、Z、W原子序数依次增大,X原子最外层电子数是电子层数的三倍,Y与X可形成Y2X2和Y2X两种离子化合物,Z原子的核外电子数比原子Y原子多1,W与X同主族,则( )
| A、气态氢化物的稳定性:X>W |
| B、单质的还原性:Y>Z |
| C、原子半径:Y<Z<W |
| D、Y和Z两者最高价氧化物对应的水化物能相互反应 |
下列说法不正确的是( )
| A、沸点大小关系为:乙酸>水>乙醇>溴乙烷>甲醛 |
| B、在水中溶解度大小关系为:乙酸异戊酯<苯酚<乙醇 |
| C、用水可以区别苯、乙醛、四氯化碳、醋酸、硝基苯五种液体 |
| D、甲醛、乙酸任意比混合,等质量的混合物完全燃烧耗氧量和生成CO2量相同 |
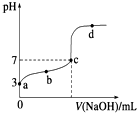 常温下下向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )
常温下下向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )| A、a点表示的溶液中c(CH3COO-)等于10-3mol?L-1 |
| B、b点表示的溶液中c(CH3COO-)>c(Na+) |
| C、c点表示的溶液中c(CH3COO-)=c(Na+) |
| D、d点表示的溶液中c(Na+)>c(CH3COO->c(OH-)>c(H+) |
下列说法正确的是( )
| A、在两支试管中分别加1mL无水乙醇和1.5g苯酚固体,再加等量的钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
| B、为降低铜锌原电池中的极化作用,可在电解质溶液中加入少量双氧水 |
| C、在制备硝酸钾晶体的实验中,趁热过滤时,承接滤液的小烧杯中先加2mL的水,以防过滤时硝酸钾晶体过早析出 |
| D、为了加快反应速率得到较干燥的硅酸白色胶状沉淀可以采用抽滤的方法 |
胡妥油(D)用作香料的原料,它可由A合成得到:

下列说法正确的是( )

下列说法正确的是( )
| A、若有机物A是由异戊二烯(C5H8)和丙烯酸(C3H4O2)加热得到的,则该反应的反应类型属于加成反应 |
| B、有机物D分子中所有碳原子一定共面 |
| C、有机物C 的所有同分异构体中不可有芳香族化合物存在 |
| D、有机物B 既能跟Na反应放出H2,又能跟NaHCO3溶液反应放出CO2气体 |
