题目内容
关于下列实验的叙述中正确的是( )
| A、溴乙烷在浓硫酸作用下加热可制得乙烯. |
| B、在制备乙酸乙酯实验中,长导管有冷凝蒸汽和导气的作用,饱和碳酸钠溶液液面上有油状并有香味液体生成 |
| C、实验室可用无水乙醇和过量的3mol/L硫酸的混合液制乙烯 |
| D、用电石和水可制得纯净的乙炔 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.溴乙烷在浓硫酸作用下不能发生消去反应;
B.长导管有冷凝蒸汽和导气的作用,使产品沿导管流下进入盛有碳酸钠的试管中,碳酸钠可吸收乙醇和乙酸,降低乙酸乙酯的溶解度;
C.3mol/L硫酸不是浓硫酸;
D.电石与水反应生成的乙炔中混有硫化氢.
B.长导管有冷凝蒸汽和导气的作用,使产品沿导管流下进入盛有碳酸钠的试管中,碳酸钠可吸收乙醇和乙酸,降低乙酸乙酯的溶解度;
C.3mol/L硫酸不是浓硫酸;
D.电石与水反应生成的乙炔中混有硫化氢.
解答:
解:A.溴乙烷在浓硫酸作用下不能发生消去反应,应利用溴乙烷在NaOH/醇溶液中加热可制得乙烯,故A错误;
B.长导管有冷凝蒸汽和导气的作用,使产品沿导管流下进入盛有碳酸钠的试管中,碳酸钠可吸收乙醇和乙酸,降低乙酸乙酯的溶解度,则饱和碳酸钠溶液液面上有油状并有香味液体生成,故B正确;
C.3mol/L硫酸不是浓硫酸,应用无水乙醇和过量浓硫酸的混合液加热至170℃制乙烯,故C错误;
D.电石与水反应生成的乙炔中混有硫化氢,应利用硫酸铜除杂得到乙炔,故D错误;
故选B.
B.长导管有冷凝蒸汽和导气的作用,使产品沿导管流下进入盛有碳酸钠的试管中,碳酸钠可吸收乙醇和乙酸,降低乙酸乙酯的溶解度,则饱和碳酸钠溶液液面上有油状并有香味液体生成,故B正确;
C.3mol/L硫酸不是浓硫酸,应用无水乙醇和过量浓硫酸的混合液加热至170℃制乙烯,故C错误;
D.电石与水反应生成的乙炔中混有硫化氢,应利用硫酸铜除杂得到乙炔,故D错误;
故选B.
点评:本题考查化学实验方案的评价,为高频考点,涉及乙烯的制备、乙炔的制备、乙酸乙酯的制备等,把握反应原理及反应条件为解答的关键,侧重有机物性质的考查,题目难度不大.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、制摩尔盐时用酒精洗涤产品,制阿司匹林时用冷水洗涤产品 |
| B、培养明矾晶体时,为得到较大颗粒的晶体,应自然冷却,并静置过夜 |
| C、做“食醋总酸含量的测定”实验时,必须先将市售食醋稀释10倍,然后用洗净的酸式滴定管量取一定体积的稀释液于洁净的锥形瓶中,锥形瓶不需要先用醋酸溶液润洗 |
| D、铁钉镀锌前,先要用砂纸打磨直至表面变得光滑,然后放入氢氧化钠溶液中浸泡5分钟,用水洗净后还需放入稀盐酸中浸泡,再用水洗净 |
取1mol H2S完全燃烧生成液态水和气态二氧化硫,放出热量为Q1;不完全燃烧生成气态水和硫,放出热量为Q2;不完全燃烧生成液态水和硫,放出热量为Q3,则下列关系正确的是( )
| A、Q3>Q2>Q1 |
| B、Q1>Q2>Q3 |
| C、Q1>Q3>Q2 |
| D、Q2>Q1>Q3 |
原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,Y能分别与X、Z形成原子个数比为1:3的共价化合物,常温下YX3是一种刺激性气味的气体.下列说法正确的是( )
| A、原子半径:Z<Y<W,而离子半径:W<Y<Z |
| B、W的氯化物水瑢液中滴加过量Z与钠形成的饱和溶液,可生成W配合物 |
| C、若由X、Y、Z组成盐的水溶液呈酸性,则溶液中该盐阳离子浓度大于酸根离子浓度 |
| D、已知YX3沸点远高于YZ3,则Y-X键的键能高于Y-Z键 |
下列对有机物的叙述中不正确的是( )
| A、邻二氯苯不存在同分异构体说明苯分子中6个碳原子之间的键是完全相同 | ||||
B、若乙酸分子中的O 都是
| ||||
| C、只用溴水就可以鉴别己烯、乙酸、苯、溴苯四种无色溶液或液体 | ||||
| D、硝基、羟基、乙基等都是官能团 |
下列说法不正确的是( )
| A、放热反应不需加热即可发生 |
| B、化学反应均伴随有能量变化,这种能量变化除热能外,还可以是光能、电能等 |
| C、可燃物的燃烧热的大小与参与反应的可燃物的多少无关 |
| D、化学反应热效应数值与参与反应的物质多少有关 |
有机物X的结构如下,下列说法正确的是( )
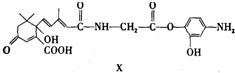

| A、X能发生氧化、取代、酯化、加聚、缩聚反应 |
| B、X与FeCl3溶液不能发生显色反应 |
| C、1mol X与足量NaOH溶液反应,最多消耗2mol NaOH |
| D、X的分子式为C23H26N2O7 |
下列说法不正确的是( )
| A、沸点大小关系为:乙酸>水>乙醇>溴乙烷>甲醛 |
| B、在水中溶解度大小关系为:乙酸异戊酯<苯酚<乙醇 |
| C、用水可以区别苯、乙醛、四氯化碳、醋酸、硝基苯五种液体 |
| D、甲醛、乙酸任意比混合,等质量的混合物完全燃烧耗氧量和生成CO2量相同 |