题目内容
8.下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
| 4 | ⑩ |
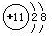 .元素⑩名称为溴.
.元素⑩名称为溴.(2)在这些元素最高价氧化物对应的水化物中,酸性最强是HClO4(填化学式)
(3)⑦的单质能与NaOH溶液反应,离子方程式为2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑
(4)⑧和⑨都是重要的非金属元素.下列叙述能说明⑨的非金属性比⑧强的是bc
a.氢化物的沸点:⑨>⑧b.⑨的单质与氢气化合比⑧的单质容易
c.⑨的单质可置换出⑧的单质 d.⑨的氢化物的酸性比⑧的氢化物的酸性强
(5)元素⑦、⑨形成的化合物中,化学键的类型为共价键.
分析 由元素在周期表的位置,可知①~⑩分别为C、N、O、F、Ne、Na、Al、S、Cl、Br,
(1)稀有气体的性质最稳定,F的非金属性最强,Na的金属性最强;
(2)元素最高价氧化物对应的水化物中,高氯酸的酸性最强;
(3)Al能与NaOH溶液反应生成偏铝酸钠和氢气;
(4)利用与氢气化合的难易程度、单质之间的置换反应、最高价含氧酸的酸性比较非金属性;
(5)⑦、⑨形成的化合物为氯化铝.
解答 解:由元素在周期表的位置,可知①~⑩分别为C、N、O、F、Ne、Na、Al、S、Cl、Br,
(1)在这些元素中,化学性质最不活泼的是:Ne,非金属性最强的元素是F,金属性最强的元素对应的离子结构示意图为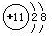 ,元素⑩名称为溴,
,元素⑩名称为溴,
故答案为:Ne; F; 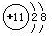 ; 溴;
; 溴;
(2)在这些元素最高价氧化物对应的水化物中,酸性最强是HClO4,故答案为:HClO4;
(3)Al能与NaOH溶液反应生成偏铝酸钠和氢气,离子反应为2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑,故答案为:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑;
(4)a.氢化物的沸点:⑨>⑧,沸点与非金属性无关,故不选;
b.⑨的单质与氢气化合比⑧的单质容易,则⑨的非金属性比⑧强,故选;
c.⑨的单质可置换出⑧的单质,则⑨的非金属性比⑧强,故选;
d.⑨的氢化物的酸性比⑧的氢化物的酸性强,不能比较非金属性,故不选;
故答案为:bc;
(5)⑦、⑨形成的化合物为氯化铝,为共价化合物,只含共价键,故答案为:共价键.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律及元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1.8 g 重水(D2O)中含有的中子数为NA | |
| B. | 常温常压下,22.4 L O2 含有的分子数为NA | |
| C. | 1 L 1 mol/L FeCl3溶液中含有Fe3+的数目为NA | |
| D. | 0.1 mol CO2分子中含有的共用电子对的数目是0.4 NA |
19.下列物质性质的变化规律与分子间作用力有关的是( )
| A. | HF、HCl、HBr、HI热稳定性依次减弱 | |
| B. | NaF、NaCl、NaBr、NaI的熔点依次降低 | |
| C. | 金刚石的硬度大于硅,其熔、沸点也高于硅 | |
| D. | F2、Cl2、Br2、I2的熔、沸点逐渐升高 |
16.将W1g光亮的铜丝在空气中加热一段时间后,迅速插入下列物质中,取出干燥,如此反复几次,最后取出铜丝用蒸馏水洗涤、干燥,称得其质量为W2 g.实验时由于所插入的物质不同,铜丝的前后质量变化可能不同,下列所插物质与铜丝的质量关系正确的是( )
| A. | 石灰水,W1=W2 | B. | 乙醇溶液,W1=W2 | C. | NaHSO4,W1<W2 | D. | CO,W1>W2 |
3.下列关于键的说法正确的是( )
| A. | 只含共价键的物质一定是共价化合物 | |
| B. | HF、HCl、HBr、HI沸点逐渐增加是因为分子量逐渐增加 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 金属与非金属之间形成的是离子键,非金属之间则形成的是共价键 |
13.下列关于气体制备不正确的是( )
| A. | 铜与稀硝酸反应制取NO2 | |
| B. | 碳酸钙与稀盐酸反应制取二氧化碳 | |
| C. | 双氧水在MnO2催化下反应制取氧气 | |
| D. | 氯化铵固体与氢氧化钙固体混合加热制取氨气 |
20.某烃的衍生物A,其分子式为C6H12O2,实验表明A和NaOH溶液共热生成B和C,B和盐酸反应生成有机物D,C在铜催化作用和加热条件下氧化为E,其中D能发生银镜反应而E不能.由此判断A的可能结构有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
18.下列化学用语和描述均正确的是( )
| A. | 结构示意图为 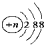 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | |
| B. | 球棍模型为  的分子可发生加成反应 的分子可发生加成反应 | |
| C. | 邻硝基甲苯的结构简式为 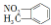 ,能发生取代反应 ,能发生取代反应 | |
| D. | 电子式分别为  和 和 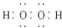 的两种化合物均为常见的氧化剂 的两种化合物均为常见的氧化剂 |
