题目内容
14. 甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2 加氢合成甲醇是合理利用CO2的有效途径.由CO2制备甲醇过程可能涉及反应如下:
甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2 加氢合成甲醇是合理利用CO2的有效途径.由CO2制备甲醇过程可能涉及反应如下:反应Ⅰ:CO2(g)+H2(g)?CO (g)+H2O(g)△H1=+41.19kJ•mol-1
反应Ⅱ:CO(g)+2H2(g)?CH3OH(g)△H2
反应Ⅲ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H3=-49.58kJ•mol-1
回答下列问题:
(1)反应Ⅲ的△S<(填“<”、“=”或“>”)0;反应Ⅱ的△H2=-90.77 kJ•mol-1.
(2)在恒压密闭容器中,充入一定量的H2和CO2(假定仅发生反应Ⅲ),实验测得反应物在不同温度下,反应体系中CO2的平衡转化率与压强的关系曲线如图1所示.
反应过程中,不能判断反应Ⅲ已达到平衡状态的标志是AD.
A.断裂3mol H-H键,同时断裂2mol H-O键 B.CH3OH的浓度不再改变
C.容器中气体的平均摩尔质量不变 D.容器中气体的压强不变.
分析 (1)反应中产物气体数和小于反应物气体系数和,据此判断反应熵变符号;根据盖斯定律确定所求反应和已知反应之间的关系,计算反应的焓变即可;
(2)反应达到平衡状态,各组分的浓度不随着时间的变化而变化,正逆反应速率相等,根据化学平衡状态的特征结合变量不变的状态是平衡状态来回答.
解答 解:(1)反应中产物气体数和小于反应物气体系数和,反应熵变小于零,
反应Ⅰ:CO2(g)+H2(g)?CO (g)+H2O(g)△H1=+41.19kJ•mol-1,
反应Ⅲ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H3=-49.58kJ•mol-1,
反应Ⅱ:CO(g)+2H2(g)?CH3OH(g)△H2可以看成是Ⅲ-Ⅰ得到,所以反应焓变=-49.58kJ•mol-1-41.19kJ•mol-1=-90.77 kJ•mol-1,
故答案为:<;-90.77 kJ•mol-1;
(2)A.断裂3molH-H键,同时有2molH-O键形成,只能说明反应正向进行,不能说明正逆反应速率相等,此时的状态不一定平衡,故A正确;
B.CH3OH的浓度不再改变的状态是平衡状态的特征,故B错误;
C.容器中气体的平均摩尔质量等于质量和物质的量的比值,质量守恒,但是物质的量始终变化,所以当气体的平均摩尔质量不变的状态是平衡状态,故C错误;
D.容器中的反应是在恒压下进行的,当容器中气体的压强不变时,不一定是平衡状态,故D正确.
故选AD.
点评 本题涉及化学平衡的判断以及热化学方程式的焓变的计算等知识,注意盖斯定律的应用是关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的 ( )
| A. | NaOH | B. | NH3•H2O | C. | CuO | D. | Cu(OH)2 |
5.在如图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )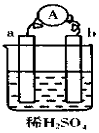

| A. | 碳棒上有气体放出,溶液pH变大 | |
| B. | a是正极,b是负极 | |
| C. | 导线中有电子流动,外电路中,电流从b极到a极 | |
| D. | a极上发生了氧化反应 |
9.下列化学用语表示不正确的是( )
| A. | S2-的结构示意图: | |
| B. | 乙烯的比例模型: | |
| C. | 乙醛的结构简式:CH3COH | |
| D. | 含中子数为10的氧元素的一种核素${\;}_8^{18}O$ |
19.19世纪末,开始揭开原子内部的秘密,最早发现电子的科学家是( )
| A. | 英国的道尔顿 | B. | 英国的卢瑟福 | C. | 丹麦的玻尔 | D. | 英国的汤姆生 |
3.元素符号、反应方程式、结构示意图、电子式、结构式等通常叫做化学用语.下列有关化学用语的表示方法中错误的是( )
| A. | 次氯酸的电子式: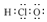 | B. | S2-的结构示意图: | ||
| C. | O-18的原子符号:${\;}_{\;}^{15}$O | D. | CO2分子的结构式:O=C=O |
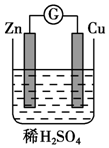 将纯锌片和纯铜片按图所示方式插入同浓度的稀硫酸中请回答下列问题:
将纯锌片和纯铜片按图所示方式插入同浓度的稀硫酸中请回答下列问题: