题目内容
3.元素符号、反应方程式、结构示意图、电子式、结构式等通常叫做化学用语.下列有关化学用语的表示方法中错误的是( )| A. | 次氯酸的电子式: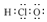 | B. | S2-的结构示意图: | ||
| C. | O-18的原子符号:${\;}_{\;}^{15}$O | D. | CO2分子的结构式:O=C=O |
分析 A.次氯酸的中心原子为O,分子中不存在H-Cl键;
B.硫离子的核电荷数为16,核外电子总数为18,最外层达到8电子稳定结构;
C.元素符号的左上角为质量数;
D.二氧化碳为直线型结构,分子中含有两个碳氧双键.
解答 解:A.次氯酸为共价化合物,中心原子为O,正确的电子式为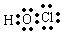 ,故A错误;
,故A错误;
B.S2-的最外层达到8电子稳定结构,其离子结构示意图为: ,故B正确;
,故B正确;
C.O-18的质量数为18,该原子正确的表示方法为:18O,故C错误;
D.CO2分子中含有两个碳氧双键,其结构式为:O=C=O,故D正确;
故选AC.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及电子式、元素符号、离子结构示意图、结构式等知识,明确常见化学用语的书写原则为解答关键,试题有利于提高学生的规范答题能力.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
13.对于某些离子的检验及结论中一定正确的是( )
| A. | 加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,则原溶液中大量含有CO32- | |
| B. | 加入稀盐酸和氯化钡溶液,有白色沉淀产生,则原溶液中一定含有SO42- | |
| C. | 分别含有Mg2+、Cu2+和Na+的三种盐酸盐溶液,用NaOH溶液就能一次鉴别开 | |
| D. | 加硝酸银溶液后产生白色沉淀,再加盐酸,白色沉淀不消失,则原溶液中一定有Cl- |
11.下列化学用语表述正确的是( )
| A. | 羟基的电子式: | B. | 聚丙烯的结构简式 | ||
| C. | 四氯化碳分子的电子式  | D. | 丙烷分子的球棍模型  |
18.实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷,装置如图所示:
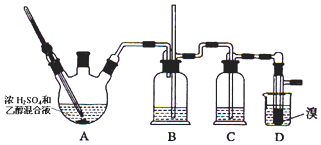
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.有关数据列表如下:
回答下列问题:
(1)写出三颈烧瓶A中发生反应的化学方程式CH3CH2OH $→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O;
(2)为了减少A装置中副反应的发生,操作时应注意迅速地把反应温度提高到170℃左右;
(3)B装置的作用为平衡气压,以获得较平稳的气流,防止倒吸,判断装置是否堵塞;
(4)在装置C中应加入NaOH溶液,除去反应中可能生成的某些杂质气体,防止对后续实验造成干扰;
(5)若产物中有少量副产物乙醚,可用蒸馏的方法除去.

可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132[ | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
(1)写出三颈烧瓶A中发生反应的化学方程式CH3CH2OH $→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O;
(2)为了减少A装置中副反应的发生,操作时应注意迅速地把反应温度提高到170℃左右;
(3)B装置的作用为平衡气压,以获得较平稳的气流,防止倒吸,判断装置是否堵塞;
(4)在装置C中应加入NaOH溶液,除去反应中可能生成的某些杂质气体,防止对后续实验造成干扰;
(5)若产物中有少量副产物乙醚,可用蒸馏的方法除去.
15.下列说法正确的是( )
| A. | 形成离子键的阴阳离子键只存在静电吸引力 | |
| B. | HF、HCl、HBr、HI的还原性从左到右依次减弱 | |
| C. | ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 | |
| D. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 |
12.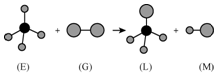 已知正四面体形分子E的直线型分子G反应,生成四面体形分子L和直线型分子M.组成E分子中的元素的原子序数都小于10,组成G分子的元素为第三周期的元素.如图,则下列判断中正确的是( )
已知正四面体形分子E的直线型分子G反应,生成四面体形分子L和直线型分子M.组成E分子中的元素的原子序数都小于10,组成G分子的元素为第三周期的元素.如图,则下列判断中正确的是( )
 已知正四面体形分子E的直线型分子G反应,生成四面体形分子L和直线型分子M.组成E分子中的元素的原子序数都小于10,组成G分子的元素为第三周期的元素.如图,则下列判断中正确的是( )
已知正四面体形分子E的直线型分子G反应,生成四面体形分子L和直线型分子M.组成E分子中的元素的原子序数都小于10,组成G分子的元素为第三周期的元素.如图,则下列判断中正确的是( )| A. | 常温常压下,L是一种液态有机物 | B. | E是一种含有非极性键的分子 | ||
| C. | 干燥的G能漂白有色物质 | D. | 上述反应的类型是取 代反应 |
13.向含amolNaOH和amolNa2CO3的混合溶液中通入bmolCO2充分反应(不考虑CO2的溶解),下列说法不正确的是( )
| A. | 当a≥2b时,发生的离子反应为:2OH-+CO2═CO32-+H2O | |
| B. | 当a=1.25b时,发生的离子方程式为:5OH-+4CO2═3HCO3-+CO32-+H2O | |
| C. | $\frac{2b}{3}$<a<2b时,溶液中CO32-与HCO3-物质的量之比为:(2b-a):(2a-b) | |
| D. | 若反应后溶液中CO32-与OH-物质的量之比为2:1,则5b=a |
 甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2 加氢合成甲醇是合理利用CO2的有效途径.由CO2制备甲醇过程可能涉及反应如下:
甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2 加氢合成甲醇是合理利用CO2的有效途径.由CO2制备甲醇过程可能涉及反应如下: 铁和铁的化合物在工业生产和日常生活中都有广泛的用途.请回答下列问题:
铁和铁的化合物在工业生产和日常生活中都有广泛的用途.请回答下列问题: