题目内容
4.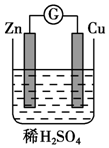 将纯锌片和纯铜片按图所示方式插入同浓度的稀硫酸中请回答下列问题:
将纯锌片和纯铜片按图所示方式插入同浓度的稀硫酸中请回答下列问题:(1)该原电池负极为:锌,电极反应式为:Zn-2e-=Zn2+正极为:铜,电极反应式为:2H++2e-═H2↑
(2)电池总反应为:Zn+2H+=Zn2++H2↑.
(3)电子流向为:由Zn片流向Cu片.
(4)电流方向为:由Cu片流向Zn片.
(5)H+移向:Cu片 SO42-移向:Zn片(填Zn片或Cu片)
分析 将纯锌片和纯铜片按图所示方式插入稀硫酸中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,电子由负极流向正极,电流由正极流向负极,阳离子移向正极,阴离子移向负极,据此分析解答.
解答 解:(1)将纯锌片和纯铜片按图所示方式插入稀硫酸中形成铜锌原电池,锌作负极,反应式为:Zn-2e-=Zn2+,铜作正极,H+在铜极上得电子,反应式为:2H++2e-═H2↑,故答案为:锌;Zn-2e-=Zn2+;铜;2H++2e-═H2↑;
(2)电池总反应为:Zn+2H+=Zn2++H2↑,故答案为:Zn+2H+=Zn2++H2↑;
(3)电子由负极流向正极,即由Zn片流向Cu片,故答案为:Zn片;Cu片;
(4)电流由正极流向负极,即由Cu片流向Zn片,故答案为:Cu片;Zn片;
(5)阳离子移向正极,阴离子移向负极所以H+移向Cu片,SO42-移向Zn片,故答案为:Cu片;Zn片.
点评 本题考查了原电池的有关知识,题目难度不大,注意把握原电池的组成条件以及原电池的工作原理,侧重于考查学生的分析能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列说法正确的是( )
| A. | 形成离子键的阴阳离子键只存在静电吸引力 | |
| B. | HF、HCl、HBr、HI的还原性从左到右依次减弱 | |
| C. | ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 | |
| D. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 |
12.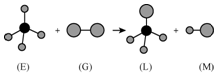 已知正四面体形分子E的直线型分子G反应,生成四面体形分子L和直线型分子M.组成E分子中的元素的原子序数都小于10,组成G分子的元素为第三周期的元素.如图,则下列判断中正确的是( )
已知正四面体形分子E的直线型分子G反应,生成四面体形分子L和直线型分子M.组成E分子中的元素的原子序数都小于10,组成G分子的元素为第三周期的元素.如图,则下列判断中正确的是( )
 已知正四面体形分子E的直线型分子G反应,生成四面体形分子L和直线型分子M.组成E分子中的元素的原子序数都小于10,组成G分子的元素为第三周期的元素.如图,则下列判断中正确的是( )
已知正四面体形分子E的直线型分子G反应,生成四面体形分子L和直线型分子M.组成E分子中的元素的原子序数都小于10,组成G分子的元素为第三周期的元素.如图,则下列判断中正确的是( )| A. | 常温常压下,L是一种液态有机物 | B. | E是一种含有非极性键的分子 | ||
| C. | 干燥的G能漂白有色物质 | D. | 上述反应的类型是取 代反应 |
19.下列各组三种元素中,属于同一周期的是( )
| A. | C、H、O | B. | F、Cl、Br | C. | Li、Mg、B | D. | Si、S、P |
9.下列有关叙述正确的是( )
| A. | 据悉中国在建的第二艘航母中使用了素有“现代工业的骨骼”之称的碳纤维,碳纤维是一种新型的有机高分子材料 | |
| B. | 离子交换膜在工业上应用广泛,如氯碱工业使用阴离子交换膜 | |
| C. | 获得2015年诺贝尔生理学、医学奖屠呦呦女士用乙醚从黄花蒿中提取出青蒿素,该技术应用了萃取原理 | |
| D. | 酸碱指示剂变色、煤的液化、蛋白质的颜色反应、海水提取溴、焰色反应都涉及化学变化 |
16.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 工业上常用电解法制备元素C、D、E的单质 | |
| C. | 常温下,元素B、D的最高价氧化物对应的水化物之间能发生反应 | |
| D. | 化合物AE与CE具有相同类型的化学键 |
13.向含amolNaOH和amolNa2CO3的混合溶液中通入bmolCO2充分反应(不考虑CO2的溶解),下列说法不正确的是( )
| A. | 当a≥2b时,发生的离子反应为:2OH-+CO2═CO32-+H2O | |
| B. | 当a=1.25b时,发生的离子方程式为:5OH-+4CO2═3HCO3-+CO32-+H2O | |
| C. | $\frac{2b}{3}$<a<2b时,溶液中CO32-与HCO3-物质的量之比为:(2b-a):(2a-b) | |
| D. | 若反应后溶液中CO32-与OH-物质的量之比为2:1,则5b=a |
18.下列化学用语对应正确的是( )
| A. | CH4分子的比例模型: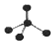 | B. | 乙酸的化学式:C2H4O2 | ||
| C. | 乙烯的结构简式CH2CH2 | D. | F-的结构示意图: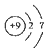 |
 甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2 加氢合成甲醇是合理利用CO2的有效途径.由CO2制备甲醇过程可能涉及反应如下:
甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2 加氢合成甲醇是合理利用CO2的有效途径.由CO2制备甲醇过程可能涉及反应如下: