题目内容
6.下列装置用于二氧化锰和浓盐酸在加热条件下反应制取纯净、干燥的氯气.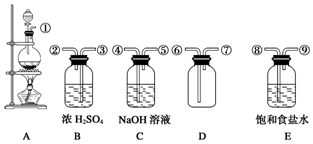
(1)写出装置A中发生的化学反应方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2
(2)在装置A~E中,用字母表示装置连接顺序依次为A、E、B、D、C.
(3)B瓶中浓H2SO4的作用是干燥氯气,E瓶盛有的饱和食盐水的作用是除氯化氢气体.
(4)C瓶中盛有NaOH溶液是为了尾气处理,吸收多余的氯气,其反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O.
分析 跟据实验的目的和反应的原理可知,实验室用二氧化锰和浓盐酸在A装置制备氯气,制得的氯气中混有氯化氢气体和水蒸气,分别通入盛有饱和氯化钠溶液的洗气瓶和盛有浓硫酸的洗气瓶,除杂干燥后用向上排空法收集氯气,氯气有毒,不能直接排放到空气中,应用盛有NaOH溶液的装置吸收氯气,反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O,据此分析解答.
解答 解:(1)装置A为二氧化锰与浓盐酸制备氯气的反应,化学方程式为:MnO2+4HCl (浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2;
故答案为:MnO2+4HCl (浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2;
(2)由分析可知,A装置制备的氯气含有氯化氢气体和水蒸气,故用盛放饱和食盐水的装置E除氯化氢,和盛放浓硫酸的装置B吸收水,在D中收集干燥的氯气,氯气有毒,最后用盛放氢氧化钠的装置C吸收;
故答案为:A;E;B;D;C;
(3)B瓶中浓H2SO4的作用是干燥氯气,E瓶盛有的饱和食盐水的作用是除氯化氢气体;
故答案为:干燥氯气;除氯化氢气体;
(4)氯气有毒,C瓶中盛有NaOH溶液是为了尾气处理,吸收多余的氯气,发生的反应为:Cl2+2NaOH=NaCl+NaClO+H2O;
故答案为:尾气处理,吸收多余的氯气;Cl2+2NaOH=NaCl+NaClO+H2O.
点评 本题考查较为综合,题目难度不大,注意实验室制备气体的实验装置和反应原理,把握物质的主要性质,会根据实验目的选取合适的装置和试剂.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
16.下列说法正确的是( )
| A. | 向某溶液中加入BaCl2溶液,产生白色沉淀,再加盐酸,沉淀不溶解,该溶液一定含有SO42- | |
| B. | 向某溶液中同时加入几滴KSCN溶液和少量新制氯水,溶液变为红色,该溶液一定含有Fe2+ | |
| C. | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体,该溶液不一定含有CO32- | |
| D. | 向某溶液中加入稀硝酸后,再加入AgNO3溶液,产生白色沉淀,则该溶液中含有Cl- |
17.向下列物质水溶液中通人过量的SO2后,最终既无沉淀也无气体产生的是( )
①H2S②NaHCO3③Na2SO3④Na2SiO3⑤Ba(NO3)2 ⑥Ca(OH)2 ⑦BaCl2.
①H2S②NaHCO3③Na2SO3④Na2SiO3⑤Ba(NO3)2 ⑥Ca(OH)2 ⑦BaCl2.
| A. | ①②④ | B. | ②③⑤ | C. | ③⑥⑦ | D. | ⑤⑥⑦ |
1.下列电离方程式不正确的是( )
| A. | Ca(OH)2═Ca2++2OH- | B. | KNO3═K++NO3- | ||
| C. | H2SO4═2H++SO42- | D. | Na2SO3═Na2++SO42- |
11.下列化学用语表述正确的是( )
| A. | 羟基的电子式: | B. | 聚丙烯的结构简式 | ||
| C. | 四氯化碳分子的电子式  | D. | 丙烷分子的球棍模型  |
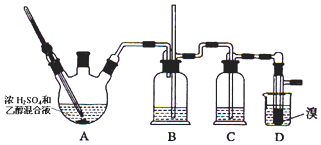
18.实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷,装置如图所示:
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.有关数据列表如下:
回答下列问题:
(1)写出三颈烧瓶A中发生反应的化学方程式CH3CH2OH $→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O;
(2)为了减少A装置中副反应的发生,操作时应注意迅速地把反应温度提高到170℃左右;
(3)B装置的作用为平衡气压,以获得较平稳的气流,防止倒吸,判断装置是否堵塞;
(4)在装置C中应加入NaOH溶液,除去反应中可能生成的某些杂质气体,防止对后续实验造成干扰;
(5)若产物中有少量副产物乙醚,可用蒸馏的方法除去.

可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132[ | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
(1)写出三颈烧瓶A中发生反应的化学方程式CH3CH2OH $→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O;
(2)为了减少A装置中副反应的发生,操作时应注意迅速地把反应温度提高到170℃左右;
(3)B装置的作用为平衡气压,以获得较平稳的气流,防止倒吸,判断装置是否堵塞;
(4)在装置C中应加入NaOH溶液,除去反应中可能生成的某些杂质气体,防止对后续实验造成干扰;
(5)若产物中有少量副产物乙醚,可用蒸馏的方法除去.
15.下列说法正确的是( )
| A. | 形成离子键的阴阳离子键只存在静电吸引力 | |
| B. | HF、HCl、HBr、HI的还原性从左到右依次减弱 | |
| C. | ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 | |
| D. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 |
16.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 工业上常用电解法制备元素C、D、E的单质 | |
| C. | 常温下,元素B、D的最高价氧化物对应的水化物之间能发生反应 | |
| D. | 化合物AE与CE具有相同类型的化学键 |
 甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2 加氢合成甲醇是合理利用CO2的有效途径.由CO2制备甲醇过程可能涉及反应如下:
甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2 加氢合成甲醇是合理利用CO2的有效途径.由CO2制备甲醇过程可能涉及反应如下: