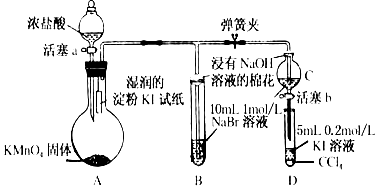
题目内容
19.下列有关非金属及其化合物的说法不正确的是( )| A. | 二氧化硅是酸性氧化物,不与任何酸反应 | |
| B. | 将氯气通入紫色石蕊试液,先变红,后褪色 | |
| C. | 次氯酸不稳定,见光易分解 | |
| D. | SO2使紫色酸性高锰酸钾溶液褪色,体现了SO2强还原性 |
分析 A、二氧化硅是酸性氧化物,能与氢氟酸反应;
B、将氯气通入紫色石蕊试液与水反应生成HCl和HClO;
C、HClO光照时生成HCl和氧气;
D、二氧化硫具有还原性,可与高锰酸钾发生氧化还原反应.
解答 解:A、SiO2能溶于氢氟酸:SiO2+4HF═SiF4↑+2H2O,故A错误;
B、将氯气通入紫色石蕊试液与水反应生成HCl和HClO,HClO具有强氧化性、漂白性,可使紫色石蕊试液先变红后褪色,故B正确;
C、HClO具有不稳定性,光照时生成HCl和氧气,故C正确;
D、二氧化硫具有还原性,可与高锰酸钾发生氧化还原反应,所以SO2使紫色酸性高锰酸钾溶液褪色,体现了SO2强还原性,故D正确;
故选A.
点评 本题考查SiO2、氯气、HClO和SO2的性质,把握物质的性质及发生的反应为解答的关键,注意二氧化硫的还原性与漂白性的区别,题目难度不大.

练习册系列答案
相关题目
9.关于如图所示各装置的叙述中,正确的是( )
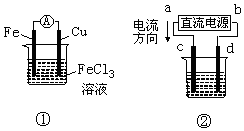

| A. | 装置①是原电池,总反应是:Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | 装置①中,铁做负极,该电极反应式为:Fe3++e-═Fe2+ | |
| C. | 装置②为铁上镀铜装置c为纯铜电极 | |
| D. | 若用装置②精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
10.下列热化学方程式正确的是( )
| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)$?_{催化剂}^{500℃、30M}$2NH3(g)?△H=-38.6 kJ•mol-1 | |
| C. | S(s)+O2(g)═SO2(g)△H=-269.8 kJ•mol-1 | |
| D. | 2NO2═O2+2NO△H=+116.2 kJ•mol-1 |
14.下列有关仪器的使用方法或实验操作正确的是( )
| A. | 盛装碱性试剂的试剂瓶应该使用橡皮塞 | |
| B. | 分离酒精和水可以采用分液法 | |
| C. | 蒸发结晶时应该将水分全部蒸干 | |
| D. | 在托盘天水左右托盘各放质量大小相同的纸,在左边纸上放氢氧化钠称量 |
4.将一固体粉末含有SiO2、Fe2O3、Al2O3,加入足量NaOH溶液充分反应后,过滤,向所得溶液中加入过量盐酸,过滤,将所得滤渣洗涤并灼烧至恒重,最终固体成份为( )
| A. | SiO2 | B. | Fe2O3、SiO2 | C. | SiO2、Al2O3 | D. | Fe2O3 |
11.下列表格中各项都正确的一组是( )
| 类别选项 | 碱 | 盐 | 电解质 | 非电解质 |
| A | 烧碱 | 小苏打 | BaSO4 | 干冰 |
| B | 纯碱 | CaCO3 | NH3•H2O | Fe |
| C | 明矾 | 食盐 | 石墨 | 醋酸 |
| D | KOH | CuSO4 | Na2SO4 | KClO3 |
| A. | A | B. | B | C. | C | D. | D |
9.关于食物的酸碱性,下列说法正确的是( )
| A. | 食物溶于水后的溶液pH<7,则称为酸性食物 | |
| B. | 由碳、氮、硫、磷等元素组成的蛋自质是酸性食物 | |
| C. | 蔬菜、水果是酸性食物 | |
| D. | 柠檬酸是酸性食物 |
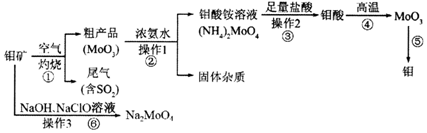
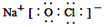 ;反应⑥生成三种钠盐,写出该反应的离子方程式:MoS2+OH-+ClO-=MoO42-+2SO42-+9Cl-+H2O
;反应⑥生成三种钠盐,写出该反应的离子方程式:MoS2+OH-+ClO-=MoO42-+2SO42-+9Cl-+H2O