题目内容
4.将一固体粉末含有SiO2、Fe2O3、Al2O3,加入足量NaOH溶液充分反应后,过滤,向所得溶液中加入过量盐酸,过滤,将所得滤渣洗涤并灼烧至恒重,最终固体成份为( )| A. | SiO2 | B. | Fe2O3、SiO2 | C. | SiO2、Al2O3 | D. | Fe2O3 |
分析 SiO2、Fe2O3、Al2O3的混合粉末,加入足量NaOH溶液,发生反应为SiO2+2NaOH═Na2SiO3+H2O,Al2O3+2NaOH=2NaAlO2+H2O,充分反应后过滤,Fe2O3不反应,则向所得溶液中加入过量盐酸,发生反应为Na2SiO3+2HCl=2NaCl+H2SiO3↓,NaAlO2+4HCl=AlCl3+NaCl+2H2O,据此分析解答.
解答 解:SiO2、Fe2O3、Al2O3的混合粉末,加入足量NaOH溶液,发生反应为SiO2+2NaOH═Na2SiO3+H2O,Al2O3+2NaOH=2NaAlO2+H2O,充分反应后过滤,Fe2O3不反应,则向所得溶液中加入过量盐酸,发生反应为Na2SiO3+2HCl=2NaCl+H2SiO3↓,NaAlO2+4HCl=AlCl3+NaCl+2H2O,过滤,所得滤渣为H2SiO3,灼烧至恒重,发生反应为:H2SiO3$\frac{\underline{\;\;△\;\;}}{\;}$SiO2+H2O,所以最终固体成份为SiO2,
故选A.
点评 本题考查元素化合物性质、基本概念等,涉及Al、Si、Fe元素及其化合物的性质,难度不大,需要学生熟练掌握基础知识.

练习册系列答案
相关题目
14.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 0.5 mol O3与11.2 L O2所含的分子数一定相等 | |
| C. | 物质的量浓度为0.5 mol/L MgCl2溶液,含有Cl-数为NA | |
| D. | 标况下,22.4 L四氯化碳的质量为154 g |
15.煤化工中常需研究不同温度下平衡常数、投料比及产率等问题.已知反应CO(g)+H2O(g)?CO2(g)+H2(g)在恒容容器中进行,平衡常数随温度的变化如表:下列判断正确的是( )
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A. | 达平衡后升温,反应速率增大,压强减小 | |
| B. | 其他条件不变,增加压强能提高CO的转化率 | |
| C. | 该反应△H>0 | |
| D. | 830℃时,在2 L的密闭容器中加入4 mol CO(g)和4 mol H2O(g),平衡时,CO的转化率是50% |
12.下列有关物质的分类不正确的是( )
| A. | 硫酸(酸) | B. | 溶液(混合物) | C. | Al2O3(两性氧化物) | D. | 纯碱(碱) |
19.下列有关非金属及其化合物的说法不正确的是( )
| A. | 二氧化硅是酸性氧化物,不与任何酸反应 | |
| B. | 将氯气通入紫色石蕊试液,先变红,后褪色 | |
| C. | 次氯酸不稳定,见光易分解 | |
| D. | SO2使紫色酸性高锰酸钾溶液褪色,体现了SO2强还原性 |
9.下列有关化学用于正确的是( )
| A. | KCl的摩尔质量是:74.5g | B. | 一水合氨的化学式为:NH4•OH | ||
| C. | Na2O2中的阴离子为:O2- | D. | 镁的原子结构示意图如图所示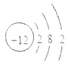 |
16.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 强碱性溶液中:K+、Al3+、Cl-、SO42- | |
| B. | 能与铝反应放出氢气的溶液中:K+、Ca2+、Cl-、HCO3- | |
| C. | pH=2的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、SCN- |
14.下列叙述正确的是( )
| A. | 直径介于1~100 nm之间的微粒称为胶体 | |
| B. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 | |
| C. | 阳离子只能得到电子被还原,阴离子只能失去电子被氧化 | |
| D. | 含有最高价态元素的化合物不一定具有很强的氧化性 |