题目内容
6.有一无色溶液可能含Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如图所示: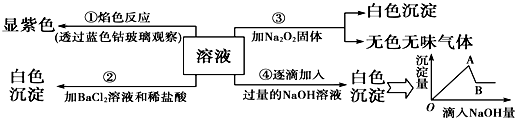
请你根据图推断:
(1)原溶液中一定存在的离子有(写化学式):K+、SO42-、Al3+、Mg2+实验④最终产生的沉淀:Mg(OH)2
(2)写出由A→B过程中所发生反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(3)过氧化钠与水反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑
(4)实验②中加入稀盐酸的目的是确定白色沉淀不是碳酸钡沉淀,而是硫酸钡沉淀.
分析 溶液透过蓝色钴玻璃焰色反应呈紫色,说明溶液中含有K+离子,溶液呈无色,则一定不含有色离子,逐滴加入过量NaOH溶液有白色沉淀,则溶液中含有Mg2+离子,
加入氯化钡和盐酸后生成白色沉淀,由于溶液中没有Ag+离子,则生成沉淀为BaSO4,溶液中含有SO42-离子,第③个实验中,生成白色沉淀的量与加入NaOH的量的先增大后减小,则说明溶液中含有Al3+离子,有Al3+则无CO32-.据此分析
解答 解:溶液透过蓝色钴玻璃焰色反应呈紫色,说明溶液中含有K+离子,溶液呈无色,则一定不含Fe3+、Fe2+、Cu2+,逐滴加入过量NaOH溶液有白色沉淀,则溶液中含有Mg2+离子,一定不含CO32-,加入氯化钡和盐酸后生成白色沉淀,由于溶液中没有Ag+离子,则生成沉淀为BaSO4,溶液中含有SO42-离子,第③个实验中,生成白色沉淀的量与加入NaOH的量的先增大后减小,则说明溶液中含有Al3+离子,一定不含有铵根离子,综上可知:原溶液中一定含有Al3+、Mg2+、K+、SO42-,一定不含Fe3+、Fe2+、NH4+、Cu2+、CO32-.
(1)原溶液中一定存在的离子有Al3+、Mg2+、K+、SO42-,由于溶液中含Al3+、Mg2+、K+、SO42-,故加入氢氧化钠溶液后,产生的沉淀有Al(OH)3、Mg(OH)2,滴加过量NaOH溶液后,Al(OH)3溶解,剩余沉淀为Mg(OH)2,故答案为:Al3+、Mg2+、K+、SO42-;Mg(OH)2;
(2)由A→B过程是氢氧化钠溶液过量,生成的Al(OH)3沉淀溶于过量的氢氧化钠溶液,离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(3)实验③中产生无色无味气体是过氧化钠与水反应,化学方程式为:2Na2O2+2H2O═4NaOH+O2↑,故答案为:2Na2O2+2H2O═4NaOH+O2↑;
(4)实验②中加入稀盐酸能排除碳酸根的干扰,确定白色沉淀不是碳酸钡沉淀,而是硫酸钡沉淀,故答案为:确定白色沉淀不是碳酸钡沉淀,而是硫酸钡沉淀.
点评 本题考查了焰色反应、常见的有色离子、离子的水解、离子反应的条件,Al(OH)3的化学性质,涉及的知识点较多,若是基础知识不扎实,恐怕难以完成.

| A. | ①③ | B. | ①②③ | C. | ①②③④ | D. | ①②④⑤ |
| A. | 离子的数目相等 | B. | 粒子的总的物质的量相等 | ||
| C. | 正电荷总数和负电荷总数应相等 | D. | 反应前后原子的数目不一定相等 |
| A. | H2与D2、T2互为同位素 | |
| B. | 氯化钠溶液和氢氧化铁胶体可以用过滤的方法分离 | |
| C. | NH3溶于水可以导电,但不是电解质 | |
| D. | SO2、NO2均属于酸性氧化物 |
| A. | NaOH | B. | CaO | C. | Na2CO3 | D. | FeSO4 |
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 50.0 | 342 |
| 硫酸钾 | 0.5 | 174 |
| 阿司匹林 | 0.4 | 180 |
| 高锰酸钾 | 0.5 | 158 |
| 硝酸银 | 0.2 | 170 |
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“营养液”中K+(阿司匹林中不含K+)的物质的量浓度为$\frac{\frac{0.5}{158}+\frac{0.5}{174}×2}{0.5}$ mol•L-1(只要求写表达式,不用写出计算结果).
(3)配制上述“营养液”500mL所需的仪器有:电子天平、药匙、烧杯、500ml容量瓶、玻璃棒、胶头滴管.(在横线上填写所缺仪器的名称)
(4)在配制一定物质的量浓度的溶液时,一般可分为以下几个步骤:①称量②计算③溶解
④摇匀⑤转移⑥洗涤⑦定容⑧冷却.其正确的操作顺序为②①③⑧⑤⑥⑦④.
(5)在溶液配制过程中,下列操作对配制结果没有影响的是BC,使所配制溶液的浓度偏高的是A,偏低的是DE.
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
D.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
E.定容时发现液面高于容量瓶的刻度线,倒出一部分液体后再加蒸馏水至刻度线.
| A. | 参与反应的过氧化钠中含阴离子2 mol | |
| B. | 参与反应的二氧化碳的体积为22.4 L | |
| C. | 反应中电子转移的数目为NA个 | |
| D. | 将生成的碳酸钠溶解在1L水中,能得到1mol/L的碳酸钠溶液 |