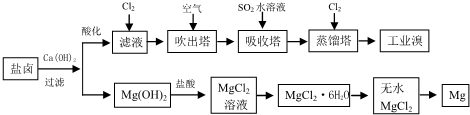
题目内容
9.正确书写离子方程式时,应使等号两边( )| A. | 离子的数目相等 | B. | 粒子的总的物质的量相等 | ||
| C. | 正电荷总数和负电荷总数应相等 | D. | 反应前后原子的数目不一定相等 |
分析 根据离子方程式的书写规则的第④步“查”可知:检查式子两边的各种原子的个数及电荷总数一定相等,即一定满足质量守恒和电荷守恒,据此进行判断.
解答 解:根据离子方程式的书写规则,等号两边的各种原子的个数及电荷数必须相等,既遵循原子守恒和电荷守恒,
如:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,表示硫酸和强碱氢氧化钡反应的离子方程式,是正确的,但等号两边离子的数目、微粒的总的物质的量、正电荷和负电荷总数不一定相等,故A、B错误;
离子方程式两边原子数目一定相等,正电荷总数和负电荷总数应相等,即:一定满足电荷守恒和质量守恒,故C正确、D错误;
故选C.
点评 本题考查了离子方程式的书写原则,题目难度不大,明确离子方程式的书写原则为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 目标测试系列答案
目标测试系列答案
相关题目
20.某化妆品的组分Z具有美白功效,原来是从杨树中提取,现在可用如下反应制备:
下列叙述不正确的是( )

下列叙述不正确的是( )
| A. | X、Y和Z均能使溴水褪色 | |
| B. | Y既能发生取代反应,也能发生加成反应 | |
| C. | X和Z均能与NaHCO3溶液反应放出CO2 | |
| D. | Y可作加聚反应单体,X可作缩聚反应单体 |
4.对下列各溶液中,微粒的物质的量浓度关系表述正确的是( )
| A. | 0.1mol•L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 0.1mol•L-1的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) | |
| C. | 0.1mol•L-1的氨水中:c(H+)=c(OH-) | |
| D. | 在25℃100mL NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3•H2O) |
4.下列离子方程式正确的是( )
| A. | CuSO4与Ba(OH)2溶液反应:Ba2++SO42-═BaSO4↓ | |
| B. | AlCl3溶液中加入过量的浓氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 用小苏打治疗胃酸过多:HCO3-+H+═H2O+CO2↑ | |
| D. | 醋酸钠和盐酸混合:CH3COONa+H+═CH3COOH+Na+ |

 汽化 ②将胆矾加热变为白色粉末
汽化 ②将胆矾加热变为白色粉末 2CO
2CO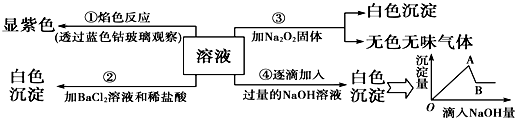
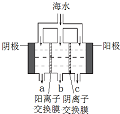 海洋是丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用.
海洋是丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用.