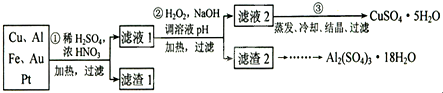
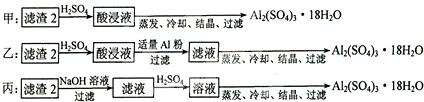
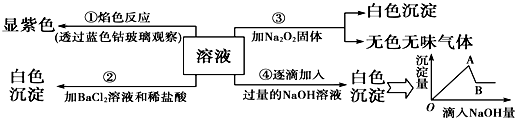
题目内容
15.在花瓶中加入“营养液”,能延长鲜花的寿命.下表是500mL“营养液”中含有的成分,阅读后回答下列问题:| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 50.0 | 342 |
| 硫酸钾 | 0.5 | 174 |
| 阿司匹林 | 0.4 | 180 |
| 高锰酸钾 | 0.5 | 158 |
| 硝酸银 | 0.2 | 170 |
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“营养液”中K+(阿司匹林中不含K+)的物质的量浓度为$\frac{\frac{0.5}{158}+\frac{0.5}{174}×2}{0.5}$ mol•L-1(只要求写表达式,不用写出计算结果).
(3)配制上述“营养液”500mL所需的仪器有:电子天平、药匙、烧杯、500ml容量瓶、玻璃棒、胶头滴管.(在横线上填写所缺仪器的名称)
(4)在配制一定物质的量浓度的溶液时,一般可分为以下几个步骤:①称量②计算③溶解
④摇匀⑤转移⑥洗涤⑦定容⑧冷却.其正确的操作顺序为②①③⑧⑤⑥⑦④.
(5)在溶液配制过程中,下列操作对配制结果没有影响的是BC,使所配制溶液的浓度偏高的是A,偏低的是DE.
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
D.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
E.定容时发现液面高于容量瓶的刻度线,倒出一部分液体后再加蒸馏水至刻度线.
分析 (1)非电解质:熔融状态和溶液中都不导电的化合物;
电解质:水溶液或者熔融状态下能够导电的化合物;
(2)K+来自高锰酸钾、硫酸钾的电离,由n=$\frac{m}{M}$计算高锰酸钾、硫酸钾的物质的量,根据钾离子守恒可知n(K+)=n(KMnO4)+2n(K2SO4),再根据物质的量浓度定义计算钾离子物质的量浓度;
(3)依据配制一定物质的量浓度溶液的一般步骤选择需要的仪器;
(4)依据配制一定物质的量浓度溶液的一般步骤排序;
(5)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
解答 解:(1)A.蔗糖在熔融状态和溶液中都不导电的化合物是非电解质,故A选;
B.硫酸钾在水溶液或者熔融状态下能够导电的化合物是电解质,故B不选;
C.高锰酸钾在水溶液或者熔融状态下能够导电的化合物是电解质,故C不选;
D.硝酸在水溶液能够导电的化合物是电解质,故D不选;
故选:A;
(2)高锰酸钾的物质的量为n(KMnO4)=$\frac{m}{M}$=$\frac{0.5g}{158g/mol}$=$\frac{0.5}{158}$mol;
硫酸钾的物质的量为n(K2SO4)=$\frac{0.5g}{174g/mol}$=$\frac{0.5}{174}$mol;
n(K+)=n(KMnO4)+2n(K2SO4)=($\frac{0.5}{158}$+$\frac{0.5}{174}$×2)mol;
c(K+)=$\frac{n}{V}$=$\frac{(\frac{0.5}{158}+\frac{0.5}{174}×2)mol}{0.5L}$=$\frac{\frac{0.5}{158}+\frac{0.5}{174}×2}{0.5}$mol/L;
故答案为:$\frac{\frac{0.5}{158}+\frac{0.5}{174}×2}{0.5}$;
(3)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶,用到的仪器为:托盘天平、药匙、烧杯、500ml容量瓶、玻璃棒、胶头滴管;所以还缺少的仪器为:
500ml容量瓶 玻璃棒 胶头滴管;
故答案为:500ml容量瓶 玻璃棒 胶头滴管;
(4)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶,所以正确的顺序为:②①③⑧⑤⑥⑦④;
故答案为:②①③⑧⑤⑥⑦④;
(5)A.定容时俯视容量瓶刻度线,导致溶液体积偏小,溶液浓度偏高;
B.容量瓶在使用前未干燥,里面有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不受影响;
C.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理,操作正确,溶液浓度不受影响;
D.转移溶液后,未洗涤烧杯和玻璃棒就直接定容,导致溶质的物质的量偏小,溶液浓度偏低;
E.定容时发现液面高于容量瓶的刻度线,倒出一部分液体后再加蒸馏水至刻度线,导致溶质的物质的量偏小,溶液浓度偏低;
所以上述操作对配制结果没有影响的是:BC;使所配制溶液的浓度偏高的是:A;偏低的是:DE;
故答案为:BC; A;DE.
点评 本题考查了电解质、非电解质的判断,有关物质的量浓度的计算,一定物质的量浓度溶液的配制过程中的计算和误差分析,明确电解质、非电解质概念、熟悉有物质的量的含义,明确配制原理及操作步骤是解题关键,题目难度不大.

 在温度为373K时,将0.100mol无色的N2O4气体通入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?2NO2的平衡.如图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
在温度为373K时,将0.100mol无色的N2O4气体通入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?2NO2的平衡.如图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)(1)该反应在60S内用NO2的表示的反应速率为0.002 mol•L-1•s-1.
(2)下表是不同温度下测定得到的该反应的化学平衡常数.
| T/K | 323 | 373 |
| K值 | 0.022 | ? |
| A. | KOH溶液与AlCl3溶液 | B. | NaAlO2溶液与盐酸 | ||
| C. | NaHCO3溶液与盐酸 | D. | Na2CO3溶液与盐酸 |
| A. | CuSO4与Ba(OH)2溶液反应:Ba2++SO42-═BaSO4↓ | |
| B. | AlCl3溶液中加入过量的浓氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 用小苏打治疗胃酸过多:HCO3-+H+═H2O+CO2↑ | |
| D. | 醋酸钠和盐酸混合:CH3COONa+H+═CH3COOH+Na+ |

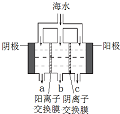 海洋是丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用.
海洋是丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用.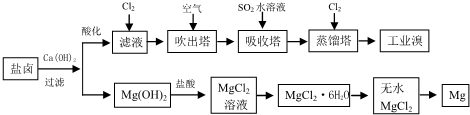

 ,化合物C所含官能团的名称为羧基.
,化合物C所含官能团的名称为羧基. ,反应类型:氧化反应.
,反应类型:氧化反应. ,写出反应②的反应方程式(标明反应条件):CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$H2O+CH2=CH2↑.
,写出反应②的反应方程式(标明反应条件):CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$H2O+CH2=CH2↑.