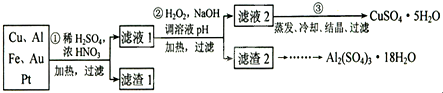
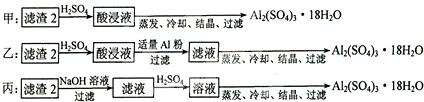
题目内容
16.常温常压下二氧化碳和过氧化钠反应后得到碳酸钠和氧气,若反应中固体质量增加了28g,反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)( )| A. | 参与反应的过氧化钠中含阴离子2 mol | |
| B. | 参与反应的二氧化碳的体积为22.4 L | |
| C. | 反应中电子转移的数目为NA个 | |
| D. | 将生成的碳酸钠溶解在1L水中,能得到1mol/L的碳酸钠溶液 |
分析 常温常压下二氧化碳和过氧化钠反应发生CO2+2Na2O2=2Na2CO3+O2,根据质量变化可知参加反应的CO2的物质的量,以此可解答该题.
解答 解:设二氧化碳和过氧化钠反应,当固体质量增加28g时,
参与反应二氧化碳的物质的量为x,
2Na2O2+2CO2═2Na2CO3+O2 固体质量差
2mol 1mol 56g
x 28g
x=1mol,所以过氧化钠的物质的量为1mol,
A、过氧化钠为1mol,含有1molO22-,故A错误;
B、状况不知,气体摩尔体积不知无法由物质的量求体积,故B错误;
C、1molNa2O2参加反应,过氧化钠既是氧化剂又是还原剂,自身的氧化还原反应,所以转移电子数为1mol,电子转移的数目为NA个,故C正确;
D、根据c=$\frac{n}{V}$公式中的V是溶液的体积而不是溶剂的体积,故D错误;
故选C.
点评 本题考查混合物的有关计算、氧化还原反应等,难度较大,确定固体质量增重的原因是关键,注意反应的相关方程式的书写.

练习册系列答案
相关题目
4.下列离子方程式正确的是( )
| A. | CuSO4与Ba(OH)2溶液反应:Ba2++SO42-═BaSO4↓ | |
| B. | AlCl3溶液中加入过量的浓氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 用小苏打治疗胃酸过多:HCO3-+H+═H2O+CO2↑ | |
| D. | 醋酸钠和盐酸混合:CH3COONa+H+═CH3COOH+Na+ |
11.物质的性质决定用途,下列说法不正确的是( )
| A. | 氢氧化钠可以作食品干燥剂 | B. | 干冰可以用于人工降雨 | ||
| C. | 稀硫酸可以除铁锈 | D. | 氯化钠可以配制生理盐水 |
1.某澄清透明溶液中只可能含有:Al3+、Mg2+、Fe3+、Fe2+、H+、CO32-、NO3-中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示.则该溶液中一定含有的离子是( )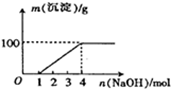

| A. | Mg2+、H+、NO3- | B. | Mg2+、Fe3+、H+、NO3- | ||
| C. | Fe3+、H+、NO3- | D. | Cu2+、H+、NO3- |

 ,化合物C所含官能团的名称为羧基.
,化合物C所含官能团的名称为羧基. ,反应类型:氧化反应.
,反应类型:氧化反应. ,写出反应②的反应方程式(标明反应条件):CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$H2O+CH2=CH2↑.
,写出反应②的反应方程式(标明反应条件):CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$H2O+CH2=CH2↑.