题目内容
有一块锌片插入足量CuSO4溶液中,锌片质量减轻了0.1g,求:
(1)参加反应的锌的物质的量;
(2)析出铜的物质的量;
(3)生成ZnSO4的物质的量及质量;
(4)溶液的质量是增加了还是减少了.
(1)参加反应的锌的物质的量;
(2)析出铜的物质的量;
(3)生成ZnSO4的物质的量及质量;
(4)溶液的质量是增加了还是减少了.
考点:化学方程式的有关计算
专题:计算题
分析:发生Zn+CuSO4=ZnSO4+Cu,称量时锌片质量减轻了0.1g,利用差量法计算参加的反应的Zn,该反应中Zn失去电子,Cu得到电子,以此计算.
解答:
解:设参加反应的Zn为xg,则
Zn+CuSO4=ZnSO4+Cu△m
65 1
x 0.1g,
=
,解得x=6.5g,
(1)参加反应的锌的物质的量是
=0.1mol,答:参加反应的锌的物质的量0.1mol;
(2)析出铜的物质的量为n(Cu)=n(Zn)=0.1mol,答:析出铜的物质的量0.1mol;
(3)生成ZnSO4的物质的量n(ZnSO4)=n(Zn)=0.1mol,质量是0.1mol×161g/mol=16.1g,答:生成ZnSO4的物质的量0.1mol,生成ZnSO4的质量16.1g;
(4)参加反应的Zn为6.5g,析出Cu为6.4g,则溶液质量增加,答:溶液的质量是增加.
Zn+CuSO4=ZnSO4+Cu△m
65 1
x 0.1g,
| 65 |
| x |
| 1 |
| 0.1 |
(1)参加反应的锌的物质的量是
| 6.5g |
| 65g/mol |
(2)析出铜的物质的量为n(Cu)=n(Zn)=0.1mol,答:析出铜的物质的量0.1mol;
(3)生成ZnSO4的物质的量n(ZnSO4)=n(Zn)=0.1mol,质量是0.1mol×161g/mol=16.1g,答:生成ZnSO4的物质的量0.1mol,生成ZnSO4的质量16.1g;
(4)参加反应的Zn为6.5g,析出Cu为6.4g,则溶液质量增加,答:溶液的质量是增加.
点评:本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及差量法计算为解答的关键,侧重分析能力及计算能力的考查,题目难度不大.

练习册系列答案
相关题目
下列有关离子方程式与所述事实相符合且正确的是( )
| A、用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O | ||||
| B、Ba(OH)2溶液中逐滴滴加NaHSO4至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | ||||
C、用饱和氯化铁溶液和沸水反应制取氢氧化铁胶体:Fe3++3H2O
| ||||
| D、在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2 Fe(OH)3=2 FeO42-+3Cl-+5H2O+4H+ |
下列图示与对应的叙述相符的是( )
A、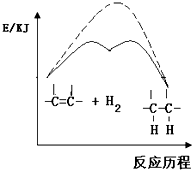 说明烯烃与H2的加成反应是放热反应,虚线表示在有催化剂的条件下表示 |
B、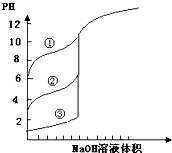 用0.1000mol/L NaOH溶液分别滴定浓度相同的三种一元酸,曲线可确定①的酸性最强 |
C、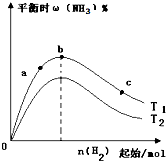 表示合成氨反应在其他条件不变的情况下,改变起始n(H2)对平衡的影响.由此可知,N2转化率最高的是b点;且T1>T2,K2>K1(T1和T2 表示温度,K1、K2表示对应温度下的平衡常数) |
D、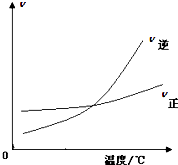 表示可逆反应“A2(g)+3B2 (g)?2AB3(g)”△H小于0 |

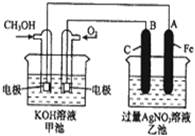
 如图所示,A、B两烧杯中均为CuCl2溶液,在两极加以必要的连接并填空:
如图所示,A、B两烧杯中均为CuCl2溶液,在两极加以必要的连接并填空: