题目内容
氨气是生产化肥、硝酸的重要原料,围绕合成氨人们进行了一系列的研究
(1)氢气既能与氮气又能与氧气发生反应,但是反应的条件却不相同.
已知:2H2(g)+O2(g)=2H2O (g)△H=-483.6kJ/mol
3H2 (g)+N2(g) 2NH3(g)△H=-92.4kJ/mol

计算断裂1mol N≡N键需要能量 kJ,氮气分子中化学键比氧气分子中的化学键键 (填“强”或“弱”),
(2)固氮是科学家致力研究的重要课题.自然界中存在天然的大气固氮过程:
N2(g)+O2(g)=2NO (g)△H=+180.8kJ/mol,工业合成氨则是人工固氮.
分析两种固氮反应的平衡常数,下列结论正确的是 .
A.常温下,大气固氮几乎不可能进行,而工业固氮非常容易进行
B.人类大规模模拟大气固氮是无意义的
C.工业固氮温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大
(3)在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料,发生反应:3H2(g)+N2(g)?2NH3(g)测得甲容器中H2的转化率为40%.
①判断乙容器中反应进行的方向 .(填“正向”或“逆向”)
②达平衡时,甲、乙、丙三容器中NH3的体积分数大小顺序为 .
(1)氢气既能与氮气又能与氧气发生反应,但是反应的条件却不相同.
已知:2H2(g)+O2(g)=2H2O (g)△H=-483.6kJ/mol
3H2 (g)+N2(g) 2NH3(g)△H=-92.4kJ/mol

计算断裂1mol N≡N键需要能量
(2)固氮是科学家致力研究的重要课题.自然界中存在天然的大气固氮过程:
N2(g)+O2(g)=2NO (g)△H=+180.8kJ/mol,工业合成氨则是人工固氮.
分析两种固氮反应的平衡常数,下列结论正确的是
| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
B.人类大规模模拟大气固氮是无意义的
C.工业固氮温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大
(3)在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料,发生反应:3H2(g)+N2(g)?2NH3(g)测得甲容器中H2的转化率为40%.
| N2 | H2 | NH3 | |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
②达平衡时,甲、乙、丙三容器中NH3的体积分数大小顺序为
考点:反应热和焓变,化学平衡建立的过程,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)反应物总键能-生成物总键能=反应热,据此计算;
键能越大,化学键越强;
(2)A、化学平衡常数说明反应进行的彻底程度问题,与反应进行的难易程度无关;
B、大气固氮的进行程度很小,利用大气固氮原理进行工业生成,产率很小;
C、合成氨是放热反应,温度越低,有利于平衡向正反应移动,反应的转化率越高;
D、化学平衡常数说明反应进行的彻底程度问题,与反应速率无关;
(3)①甲、乙是完全等效平衡,平衡时对应各组分的物质的量相等,根据甲中氢气的转化率计算平衡时氢气的物质的量,与乙中氢气的物质的量比较,判断反应进行方向;
②甲、乙是完全等效平衡,平衡时NH3的体积分数相等,丙相当于在甲平衡的基础上,再加入1molN2、3molH2,压强增大平衡向正反应方向移动,据此解答.
键能越大,化学键越强;
(2)A、化学平衡常数说明反应进行的彻底程度问题,与反应进行的难易程度无关;
B、大气固氮的进行程度很小,利用大气固氮原理进行工业生成,产率很小;
C、合成氨是放热反应,温度越低,有利于平衡向正反应移动,反应的转化率越高;
D、化学平衡常数说明反应进行的彻底程度问题,与反应速率无关;
(3)①甲、乙是完全等效平衡,平衡时对应各组分的物质的量相等,根据甲中氢气的转化率计算平衡时氢气的物质的量,与乙中氢气的物质的量比较,判断反应进行方向;
②甲、乙是完全等效平衡,平衡时NH3的体积分数相等,丙相当于在甲平衡的基础上,再加入1molN2、3molH2,压强增大平衡向正反应方向移动,据此解答.
解答:
解:(1)N≡N键能为x,则3×436kJ/mol+x-2×1173.2kJ/mol=-92.4kJ/mol,解得x=946kJ/mol,故断裂1mol N≡N键需要能量是946kJ,O=O键能是498kJ/mol,故氮气分子中化学键比氧气分子中的化学键强,
故答案为:946;强;
(2)A、化学平衡常数说明反应进行的彻底程度问题,与反应进行的难易程度无关,故A错误;
B、大气固氮的进行程度很小,利用大气固氮原理进行工业生成,产率很小,没有实际意义,故B正确;
C、合成氨是放热反应,温度越低,有利于平衡向正反应移动,反应的转化率越高,反应越完全,故C正确;
D、化学平衡常数说明反应进行的彻底程度问题,与反应速率无关,故D错误;
故答案为:BC;
(3)①甲、乙是完全等效平衡,平衡时对应各组分的物质的量相等,平衡时甲容器中H2的转化率为40%,则平衡时氢气的物质的量为3mol×(1-40%)=1.8mol,乙中氢气为1.5mol,小于1.8mol,则乙容器中反应进行的方向是逆向,
故答案为:逆向;
②甲、乙是完全等效平衡,平衡时NH3的体积分数相等,丙相当于在甲平衡的基础上,再加入1molN2、3molH2,压强增大平衡向正反应方向移动,氨气的体积分数增大,故体积分数:丙>甲=乙,
故答案为:丙>甲=乙;
故答案为:946;强;
(2)A、化学平衡常数说明反应进行的彻底程度问题,与反应进行的难易程度无关,故A错误;
B、大气固氮的进行程度很小,利用大气固氮原理进行工业生成,产率很小,没有实际意义,故B正确;
C、合成氨是放热反应,温度越低,有利于平衡向正反应移动,反应的转化率越高,反应越完全,故C正确;
D、化学平衡常数说明反应进行的彻底程度问题,与反应速率无关,故D错误;
故答案为:BC;
(3)①甲、乙是完全等效平衡,平衡时对应各组分的物质的量相等,平衡时甲容器中H2的转化率为40%,则平衡时氢气的物质的量为3mol×(1-40%)=1.8mol,乙中氢气为1.5mol,小于1.8mol,则乙容器中反应进行的方向是逆向,
故答案为:逆向;
②甲、乙是完全等效平衡,平衡时NH3的体积分数相等,丙相当于在甲平衡的基础上,再加入1molN2、3molH2,压强增大平衡向正反应方向移动,氨气的体积分数增大,故体积分数:丙>甲=乙,
故答案为:丙>甲=乙;
点评:本题考查反应热的有关计算、平衡常数意义、等效平衡等,难度中等,注意(3)中等效平衡的理解与构建平衡建立的等效途径.

练习册系列答案
相关题目
下列各组物质能在水溶液中大量共存的是( )
| A、Na+、K+、HCO3-、CO32- |
| B、Ca2+、Ba2+、HCO3-、OH- |
| C、Na+、HSO4-、S2-、SO32- |
| D、Ca2+、Na+、HCO3-、ClO- |
在给定的四种溶液中,加入以下各种离子后,各离子能在原溶液中大量共存的有( )
| A、滴加酚酞试液显红色的溶液:Fe2+、NH4+、Cl-、I- |
| B、水电离出来的C (H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ |
| C、在C (H+)=10-13mol/L的溶液:K+、SO42-、Al3+、Cl- |
| D、PH=1的溶液:Cu2+、Na+、Mg2+、NO3- |
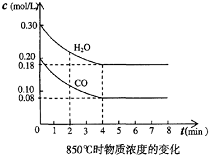 (1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0
(1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0