题目内容
6.焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验:实验一 焦亚硫酸钠的制取
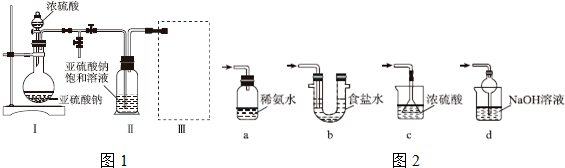
采用如图1装置(实验前除尽装置内的空气)制取Na2S2O5.装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2═Na2S2O5.
(1)装置Ⅰ中产生气体的化学方程式为Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2)图1中盛装浓硫酸的玻璃仪器的名称是:分液漏斗;
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为d(填序号).
实验二 焦亚硫酸钠的性质(Na2S2O5溶于水即生成NaHSO3)
(4)焦亚硫酸钠Na2S2O5晶体中所含的化学键类型为:离子键和共价键;
(5)证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是ae(填序号).
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂.测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O═H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为0.16g•L-1.
②在上述实验过程中,若有部分HI被空气氧化,则测定结果偏低(填“偏高“、“偏低”或“不变”).
分析 (1)由装置Ⅱ中发生的反应可知,装置Ⅰ中产生的气体为SO2,亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水;
(2)图1中盛装浓硫酸的玻璃仪器名称为分液漏斗;
(3)处理过量的SO2尾气,既要吸收SO2尾气,同时能防倒吸;
(4)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键;
(5)NaHSO3溶液中HSO3-的电离程度大于水解程度,溶液呈酸性,故检验溶液呈酸性即可;
(6)①根据反应“SO2+I2+2H2O=H2SO4+2HI”,则样品中抗氧化剂的残留量=$\frac{0.01mol/L×0.025L×64g/mol}{0.1000L}$=0.16 g/L;
②若有部分HI被空气氧化又生成I2,导致消耗标准I2溶液的体积偏小,则测得结果偏低.
解答 解:(1)由装置Ⅱ中发生的反应可知,装置Ⅰ中产生的气体为SO2,亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水,反应方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2)图1中盛装浓硫酸的玻璃仪器名称为分液漏斗,可以通过活塞控制滴加液体速率,
故答案为:分液漏斗;
(3)a.装置应将导管深入氨水中可以吸收二氧化硫,但为密闭环境,装置内压强增大易产生安全事故,故错误;
b.该装置吸收二氧化硫能力较差,且为密闭环境,装置内压强增大易产生安全事故,故错误;
c.该装置不能吸收二氧化硫,所以无法实现实验目的,故错误;
d.该装置中氢氧化钠与二氧化硫反应,可以吸收,且防止倒吸,故正确;
故答案为:d;
(4)焦亚硫酸钠Na2S2O5晶体中焦亚硫酸根离子和钠离子之间存在离子键,硫原子和氧原子之间存在共价键,
故答案为:离子键和共价键;
(5)NaHSO3溶液中HSO3-的电离程度大于水解程度,溶液呈酸性,测定溶液的pH,可以确定溶液酸碱性,酸性溶液可以使湿润蓝色石蕊试纸变红,所以能用测定溶液pH值、湿润的蓝色石蕊试液检验,而加入Ba(OH)2溶液、HCl溶液、品红溶液都不能说明溶液呈酸性,故选ae;
故答案为:ae;
(6)①根据反应“SO2+I2+2H2O=H2SO4+2HI”,则样品中抗氧化剂的残留量=$\frac{0.01mol/L×0.025L×64g/mol}{0.1000L}$=0.16 g/L,故答案为:0.16;
②若有部分HI被空气氧化又生成I2,导致消耗标准I2溶液的体积偏小,则测得结果偏低,故答案为:偏低.
点评 本题考查SO2的制取,Na2S2O5含量的测定,实验操作等基础知识,题目难度中等,掌握实验原理是解题的关键.

 一线名师提优试卷系列答案
一线名师提优试卷系列答案| A. |  分散系的分类 | B. |  比较Na2CO3、NaHCO3的稳定性 | ||
| C. |  向Na2CO3溶液中逐滴滴入盐酸 | D. |  向Al溶液中滴加过量的NaOH溶液 |
| A. | 钱恩 | B. | 屠呦呦 | C. | 弗莱明 | D. | 莫言 |
①向饱和Na2CO3溶液中通入过量CO2
②向Fe(OH)3胶体中逐滴滴入过量的H2SO4
③向Ba(NO3)2溶液中通入过量SO2
④向石灰水中通入过量CO2
⑤向Na2SiO3溶液中滴入过量的盐酸.
| A. | ①③⑤ | B. | ①②⑤ | C. | ①②③⑤ | D. | ①②③ |
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电力平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A. | NaCN溶液中通入少量CO2发生的离子反应为:2CN-+H2O+CO2=2HCN+CO${\;}_{3}^{2-}$ | |
| B. | 处理含CN-废水时,如用NaOH溶液调节pH至9,此时c(CN-)<c(HCN) | |
| C. | 中和等体积、等pH的甲酸溶液和氢氰酸溶液消耗NaOH的物质的量前者小于后者 | |
| D. | 等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者 |
| A. | 0.1 mol•L-1FeCl3溶液中:K+、Na+、AlO2-、SCN- | |
| B. | 能溶解CaCO3的溶液中:Fe2+、Ca2+、Cl-、NO${\;}_{{3}_{\;}^{\;}}^{-}$ | |
| C. | 澄清透明的溶液中:Cu2+、Mg2+、SO${\;}_{4}^{2-}$、Cl- | |
| D. | 由水电离得到的c(H+)=1×10-13mol•L-1的溶液中:Mg2+、Cu2+、SO42-、NO3- |