��Ŀ����
13�� ��һ�������£���������������������·�Ӧ��2SO2��g��+O2 ��g��?2SO3��g�� ����H��0��
��һ�������£���������������������·�Ӧ��2SO2��g��+O2 ��g��?2SO3��g�� ����H��0����1��д���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK=$\frac{{c}^{2}��S{O}_{3}��}{{c}^{2}��S{O}_{2}��c��{O}_{2}��}$��
��2�������¶ȣ��÷�ӦKֵ����������ת�����������Ͼ�������С�䣩��
��3����ͼ�жϣ���Ӧ������20minʱ�����߷����仯��ԭ����������������Ũ�ȣ���ͨ����������
��4��10min��15min�����߱仯��ԭ�������ab����д��ţ���
a�����˴��� b����С������� c�������¶� d������SO3�����ʵ�����
���� ��1��KΪ������Ũ����֮���뷴Ӧ��Ũ����֮���ıȣ�
��2���÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���
��3����ͼ��֪����Ӧ������20minʱ��������Ũ��ͻȻ����ƽ�������ƶ������������Ũ�ȼ�С�����������Ũ������
��4��10min��15min������б������Ӧ���ʼӿ죬�Դ������
��� �⣺��1����2SO2��g��+O2 ��g��?2SO3��g�� ��֪��K=$\frac{{c}^{2}��S{O}_{3}��}{{c}^{2}��S{O}_{2}��c��{O}_{2}��}$���ʴ�Ϊ��$\frac{{c}^{2}��S{O}_{3}��}{{c}^{2}��S{O}_{2}��c��{O}_{2}��}$��
��2���÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ������¶ȣ��÷�ӦKֵ����������ת�������ʴ�Ϊ����������
��3����ͼ��֪����Ӧ������20minʱ��������Ũ��ͻȻ����ƽ�������ƶ������������Ũ�ȼ�С�����������Ũ�����������߷����仯��ԭ����������������Ũ�ȣ���ͨ�����������ʴ�Ϊ��������������Ũ�ȣ���ͨ����������
��4��10min��15min������б������Ӧ���ʼӿ죬�Ӵ�������С����������ӿ췴Ӧ���ʣ������¶ȷ�Ӧ���ʼ�С��������SO3�����ʵ���ƽ�������ƶ�����Ӧ��Ũ��������ͼ�����ʴ�Ϊ��ab��
���� ���⿼�黯ѧƽ��ļ��㣬Ϊ��Ƶ���㣬����K�ı���ʽ��Ӱ�����ء�ƽ���ƶ�Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע��ͼ����ƽ���ƶ�ԭ���Ľ�ϣ���Ŀ�ѶȲ���

| A�� | ֻ�з�Ӧ�٢ڢ�����������ԭ��Ӧ | |
| B�� | ��Ӧ��˵���������������������۵�ϸߵĽ��� | |
| C�� | ��ͬ���������ɵ�����O2����Ӧ�ۺ͢�ת�Ƶĵ�����֮��Ϊ1��1 | |
| D�� | ��Ӧ�����������뻹ԭ�������ʵ���֮��Ϊ1��4 |
 �ȼ��仯�������������������й㷺����;���ش��������⣺
�ȼ��仯�������������������й㷺����;���ش��������⣺��1����������������ָ�ڼ�����������Cl2����ˮ�е�CN-�����������ʣ�д���÷�Ӧ�����ӷ���ʽ��5Cl2+2CN-+8OH-�T10Cl-+N2��+2CO2��+4H2O��
��2���ؿ����Ʊ������ķ�ӦΪ4HCl��g��+O2��g��$\frac{\underline{\;CuO/CuCl_{2}\;}}{400��}$2Cl2��g��+2H2O��g����H=-115.6kJ•mol-1��1molH-Cl��1molCl-Cl��1molO-O����ʱ�ֱ���Ҫ����431J��243kJ��489kJ����������1molO-H����ʱ�����յ�����Ϊ460.65kJ��
��3��ȡClO2������������ˮ���ٶ�ClO2ȫ��ת��ΪCl-��30.00mL����ˮ���м��뼸��K2CrO4��Һ��ָʾ������һ��Ũ��AgNO3��Һ�ζ�������ש��ɫ��Ag2CrO4��������ʱ����Ӧ�ﵽ�ζ��յ㣬�����Һ��CrO42-��Ũ����5.00��10-3mol•L-1����ζ��յ�ʱ��Һ��c��Cl-��=8.90��10-6mol/L��[��֪��Ksp��AgCl��=1.78��10-10��Ksp��Ag2CrO4��=2.00��10-12]
��4����5�����¡������ܱ������зֱ����4molClO2��g����������Ӧ��4ClO2����g��?2Cl2O��g��+3O2��g����H��0�����ClO2��g���IJ���ƽ��ת���������ʾ��
| ������� | �¶�/ | �������/L | ClO2��g����ƽ��ת���� |
| a | T1 | V1=1L | 75% |
| b | T2 | V2 | |
| c | T3 | V3 | 75% |
| d | |||
| e |
�ٸ÷�Ӧ��Cl2O�ǻ�ԭ������ԭ����������������
��T1��ʱ��������Ӧ��ƽ�ⳣ��K=25.63��
��V2�������������������=����V3��
��d��c�������еķ�Ӧ��a�����еķ�Ӧ������һ��������ͬ��a��d��e�������з�Ӧ��ϵ��ѹǿ��ʱ��ı仯��ͼ��ʾ��a��d��e��������ClO2��ƽ��ת�����ɴ�С������˳��Ϊe��a=d������ĸ��ʾ������a������ȣ�d�����иı��һ��ʵ�������Ǽ�����������ж�������adͼ�������߱仯��֪��d��Ӧ��������ѹǿ����ƽ��㲻�䣮
��1��ij�¶��£�2SO2��g��+O 2��g���T2SO3��g����H=-197kJ/mol����ʼʱ��10L���ܱ������м���8.0mol SO2��g����20.0mol O 2��g��������Ӧ�ﵽƽ��ʱ���ų�394kJ�����������¶��µ�ƽ�ⳣ��K=0.56��mol/L��-1��������λ��Ч���֣����������¶�ʱ��K����С�������С�䡱����
��2�����������������£����д�ʩ�����������SO2��ת����������AC������ĸ����
A��ͨ������ B���Ƴ����� C������ѹǿ D����Сѹǿ E���������
��3�������±��ṩ�IJ�ͬ������SO2��ת���ʣ�%�������ݣ���ѡ��÷�Ӧ��������������V2O5���������¶�450�棻ѹǿ1��105Pa��
| ѹǿ �¶� | 1��105Pa | 5��105Pa | 10��105Pa | 50��105Pa | 100��105Pa |
| 450�� | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 500�� | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
A��������ѹǿ���� B�����������ܶȲ���
C�����������SO 3��Ũ�Ȳ��� D��c��SO 2��=c��SO 3��
E��v ����SO 2��=v ����SO 3�� F��v ����SO 3��=2v �棨O 2��
���о���ѧ��Ӧԭ���������������Ǻ�������ģ�
��1����0.10mol•L-1����ͭ��Һ�м�����������ϡ��Һ��ֽ��裬��dz��ɫ������ͭ�������ɣ�����Һ��pH=8ʱ��c��Cu2+��=2.2��10-8mol•L-1��Ksp[Cu��OH��2]=2.2��10-20����
��2������0.1mol•L-1����ͭ��Һ��ͨ��H2S���壬ʹCu2+��ȫ����ΪCuS����ʱ��Һ�е�H+Ũ����0.2mol•L-1��
| t/�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
��1���÷�ӦΪ���ȷ�Ӧ������ȡ��������ȡ�����д���÷�Ӧ��ƽ�ⳣ������ʽ��K=$\frac{c��CO��c��{H}_{2}O��}{c��C{O}_{2}��c��{H}_{2}��}$��
��2����ʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����bc��
a����ʱ�����CO���� b���ʵ������¶�
c������CO2��Ũ�� d��ѡ���Ч����
��3�����жϸ÷�Ӧ�Ƿ�ﵽ��ѧƽ��״̬��������bc��
a��������ѹǿ���� b����������� c��CO������
c��v����H2��=v����H2O�� d��c��CO2��=c��CO��
��4��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��c��CO2��•c��H2��=c��CO��•c��H2O�������жϴ�ʱ���¶�Ϊ830�森
��5�����ڣ�4���������¶��£���1L���ܱ������У�����2molCO2��3molH2��ַ�Ӧ��ƽ��ʱ��H2�����ʵ���Ϊb��CO2�����ʵ���Ϊc��
a������1.0mol b������1.0mol
c������0.5mol��С��1.0mol d����ȷ����
| A�� | Na+��NO3-��Cl- | B�� | Cu2+��K+��NO3- | C�� | H+��HCO3-��NO3- | D�� | Na+��Ba2+��SO42- |

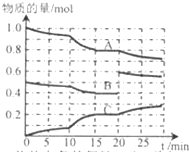 �ں㶨�¶�t�棬2L�����ܱ������з�����ӦaA��g��+bB��g��?cC��g����������A��B��C���ʵ����仯��ͼ��ʾ���ش��������⣺
�ں㶨�¶�t�棬2L�����ܱ������з�����ӦaA��g��+bB��g��?cC��g����������A��B��C���ʵ����仯��ͼ��ʾ���ش��������⣺