题目内容
20.如图为元素周期表的一部分,参照元素①~⑦在表中的位置,请用相关的化学用语回答下列问题: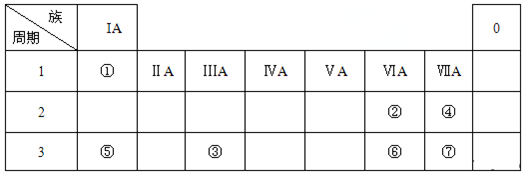
(1)④、⑤、⑦的原子半径由大到小的顺序为Na>Cl>P.
(2)⑥和⑦的最高价氧化物对应的水化物的酸性强弱为HClO4>H2SO4.
(3)③最高价氧化物对应的水化物与⑤最高价氧化物对应的水化物的反应方程式Al(OH)3+NaOH=NaAlO2+2H2O.
分析 由元素在周期表的位置可知,①~⑦分别为H、O、F、Na、Al,S、Cl,
(1)电子层越多,原子半径越大,同周期从左向右原子半径减小;
(2)非金属性越强,对应最高价氧化物对应的水化物的酸性越强;
(3)③最高价氧化物对应的水化物为氢氧化铝,⑤最高价氧化物对应的水化物为NaOH,二者反应生成偏铝酸钠和水.
解答 解:由元素在周期表的位置可知,①~⑦分别为H、O、F、Na、Al,S、Cl,
(1)电子层越多,原子半径越大,同周期从左向右原子半径减小,则④、⑤、⑦的原子半径由大到小的顺序为Na>Cl>P,故答案为:Na>Cl>P;
(2)非金属性Cl>S,则⑥和⑦的最高价氧化物对应的水化物的酸性强弱为HClO4>H2SO4,故答案为:HClO4;H2SO4;
(3)③最高价氧化物对应的水化物与⑤最高价氧化物对应的水化物的反应方程式为Al(OH)3+NaOH=NaAlO2+2H2O,故答案为:Al(OH)3+NaOH=NaAlO2+2H2O.
点评 本题考查位置、结构与性质,为高频考点,把握元素在周期表的位置、元素周期律、元素化合物为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
6.Zn-ZnSO4-PbSO4-Pb电池装置如图,下列说法错误的是( )
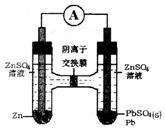

| A. | SO42-从右向左迁移 | |
| B. | 电池的正极反应为:Pb2++2e-═Pb | |
| C. | 左边ZnSO4浓度增大,右边ZnSO4浓度不变 | |
| D. | 若有6.5g锌溶解,有0.1 molSO42-通过离子交换膜 |
7.下列试剂需要保存在棕色试剂瓶中的是( )
| A. | 浓硫酸 | B. | 液溴 | C. | 酒精 | D. | 澄清石灰水 |
8.用括号内试剂除去下列各物质中的少量杂质,正确的是( )
| A. | 溴苯中的溴(KI溶液) | B. | 乙烷中的乙烯(KMnO4酸性溶液) | ||
| C. | 乙酸乙酯中的乙酸(饱和Na2CO3溶液) | D. | 苯中的甲苯(溴水) |
15.以铅蓄电池为电源,将CO2转化为乙烯的装置如图所示,电解所用电极材料均为惰性电极.下列说法不正确的是( )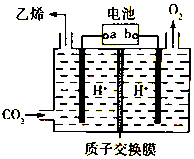

| A. | b为铅蓄电池的正极 | |
| B. | 电解过程中,阳极区溶液中c(H+)逐渐减小 | |
| C. | 阴极反应式:2CO2+12H++12e-═C2H4+4H2O | |
| D. | 每生成1mol乙烯,理论上铅蓄电池中消耗12mol硫酸 |
12. 甲醇是重要的化工原料,又可作为燃料.工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可作为燃料.工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)?CH3OH(g)△H=-99kJ/mol
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-58kJ/mol
③CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41kJ/mol
回答下列问题:
(1)已知反应①中相关的化学键键能数据如表:
则x=413.
(2)反应①能够自发进行的条件是较低温度(填“较低温度”、“较高温度”或“任何温度”).
(3)恒温,恒容密闭容器中,对于反应②,下列说法中能说明该反应达到化学平衡状态的是BD.
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1
D.甲醇的百分含量不再变化
(4)对于反应②,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法
不正确的是ABD.
A.不同条件下反应,N点的速率最大
B.温度低于250℃时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)若在1L密闭容器中充入体积比为 3:1的 H2 和CO2发生反应②,则图中M点时,产物甲醇的体积分数为16.7%;若要进一步提高甲醇的体积分数,可采取的措施有增大压强(答一种措施).
(6)甲醇在催化剂条件下可以直接氧化成甲酸.常温下用0.1000mol•L-1NaOH滴定 20.00mL 0.1000mol•L-1的甲酸.当溶液中c(HCOOH)=c(HCOO-)时,测得PH=4.
①PH=4时,该溶液中离子浓度由小到大的顺序为c(OH-)<c(H+)<c(Na+)<c(HCOO-);
②PH=7时,c(HCOOH)+c(HCOO-)>0.050mol•L-1(填“>”、“<”或“=”)
 甲醇是重要的化工原料,又可作为燃料.工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可作为燃料.工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:①CO(g)+2H2(g)?CH3OH(g)△H=-99kJ/mol
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-58kJ/mol
③CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41kJ/mol
回答下列问题:
(1)已知反应①中相关的化学键键能数据如表:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(KJ•mol-1) | 436 | 343 | 1076 | 465 | x |
(2)反应①能够自发进行的条件是较低温度(填“较低温度”、“较高温度”或“任何温度”).
(3)恒温,恒容密闭容器中,对于反应②,下列说法中能说明该反应达到化学平衡状态的是BD.
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1
D.甲醇的百分含量不再变化
(4)对于反应②,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法
不正确的是ABD.
A.不同条件下反应,N点的速率最大
B.温度低于250℃时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)若在1L密闭容器中充入体积比为 3:1的 H2 和CO2发生反应②,则图中M点时,产物甲醇的体积分数为16.7%;若要进一步提高甲醇的体积分数,可采取的措施有增大压强(答一种措施).
(6)甲醇在催化剂条件下可以直接氧化成甲酸.常温下用0.1000mol•L-1NaOH滴定 20.00mL 0.1000mol•L-1的甲酸.当溶液中c(HCOOH)=c(HCOO-)时,测得PH=4.
①PH=4时,该溶液中离子浓度由小到大的顺序为c(OH-)<c(H+)<c(Na+)<c(HCOO-);
②PH=7时,c(HCOOH)+c(HCOO-)>0.050mol•L-1(填“>”、“<”或“=”)
9.X、Y是短周期主族元素,常温常压下,两元素形成的单质分别为m、n,m为气态、n为固态,下列推断合理的是( )
| A. | 若X,Y位于IA族,则化合物YX与水反应时水作还原剂 | |
| B. | 若X、Y位于第三周期,则X、Y形成的化合物只含离子键 | |
| C. | 若氢化物还原性HaX<HbY,则单质氧化性m>n | |
| D. | 若X、Y位于同一主族,则简单离子半径X>Y |
10.下列说法正确的是( )
| A. | 等物质的量的O2和O3含有相同的质子数 | |
| B. | 水是一种非常稳定的化合物,这是由于氢键所致 | |
| C. | 分子晶体中一定存在分子间作用力,但可能没有共价键 | |
| D. | 将标准状况下22.4 L 氨气溶于1 L水配成溶液,可得1 mol•L-1的氨水 |
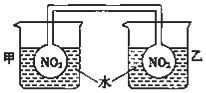 利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程.
利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程.