题目内容
5.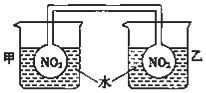 利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程.
利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程.①按图所示将实验装置连接好.
②向甲烧杯的水中投入一定量的CaO固体,此烧杯中的NO2平衡混合气体的红棕色变深;向乙烧杯中加入NH4NO3晶体,此时烧杯中NO2平衡混合气体颜色变浅.
试根据以上信息回答下列问题:
(1)CaO与水反应的化学方程式为CaO+H2O═Ca(OH)2,该反应中,反应物的总能量大于生成物的总能量(填“大于”、“小于”或“等于”).
(2)查阅资料知NO2的平衡气体中存在的可逆反应为2NO2(g)?N2O4(g),已知NO2为红棕色,N2O4为无色,结合实验可知,当温度升高时,平衡发生移动(填“未被破坏”或“发生移动”),此时反应速率增大(填“增大”、“减小”或“不变化”).混合气体的颜色不变能(填“能”或“不能”)证明反应已达到平衡状态.
分析 (1)CaO与水反应生成氢氧化钙,该反应是放热反应,结合反应物、生成物总能量与反应热的关系分析;
(2)2NO2(g)?N2O4(g)正反应是放热反应,所以升高温度逆向移动,正逆反应速率都加快,混合气体的颜色不变说明二氧化氮的浓度不变,化学反应达平衡状态.
解答 解:(1)CaO与水反应生成氢氧化钙,反应方程式为CaO+H2O═Ca(OH)2,该反应为放热反应,则反应物的总能量大于生成物的总能量,
故答案为:CaO+H2O═Ca(OH)2;大于;
(2)2NO2(g)?N2O4(g)正反应是放热反应,所以升高温度逆向移动,正逆反应速率都增大,混合气体的颜色不变说明二氧化氮的浓度不变,说明正逆反应速率相等,该化学反应达平衡状态,
故答案为:发生移动;增大;能.
点评 本题考查化学平衡的影响因素、反应热与焓变,题目难度不大,明确化学平衡及其影响为解答关键,注意掌握化学反应与能量变化的关系,试题培养了学生的分析能力及综合应用能力.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
11.为实现实验目的,选用的装置、实验操作均正确的是( )
| 实验目的 | 实验步骤和装置 | |
| A | 探究温度对反应速率的影响 | 不同温度下,分别取同体积0.1mol•L-1KI溶液,向其中匀先加入淀粉溶液3滴,再各加入0.1mol•L-1硫酸5滴,并同时记录溶液出现蓝色的时间 |
| B | 配制100mL1.0mol•L-1NaOH溶液 | 向100mL容量瓶中加入4.0gNaOH固体,加水到刻度线 |
| C | 验证牺牲阳极的阴极保护法 |  往铁电极附近滴加铁氯化钾溶液 |
| D | 比较H2O2和Fe3+的氧化性 | 将盐酸酸化的双氧水滴入Fe(NO3)2溶液中 |
| A. | A | B. | B | C. | C | D. | D |
12.等量的铁粉分别与足量的盐酸、水蒸气在一定的条件下充分反应,则在相同的条件下,产生氢气的物质的量之比是( )
| A. | 1:1 | B. | 3:4 | C. | 2:3 | D. | 4:3 |
13.电化学在日常生活中用途广泛,图甲是镁-次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含Cr2O72-的工业废水的处理.下列说法正确的是( )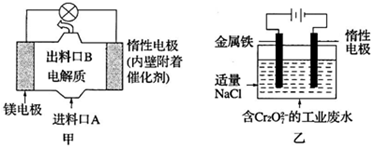

| A. | 图甲中发生的氧化反应是Mg2++ClO-+H2O+2e-═Cl-+Mg(OH)2↓ | |
| B. | 图乙中惰性电极棒上有O2放出 | |
| C. | 图乙中Cr2O72-向惰性电极移动,与该极近的OH-结合转化成Cr(OH)3除去 | |
| D. | 若图甲中3.6g镁产生的电量用于图乙废水处理,理论上图乙中有8.4g阳极材料参与反应 |
17.已知:用Pt-Rh合金催化氧化NH3制NO,其反应的微观模型及含氮生成物产率随反应温度的变化曲线分别如图①、图②所示:下列说法中,不正确的是( )


| A. | 400℃时,生成的产物有N2、NO、H2O | |
| B. | 800℃时,反应的化学方程式是:4NH3+5O2$\frac{\underline{\;Pt-Rh\;}}{800℃}$ 4NO+6H2O | |
| C. | 400℃-800℃间,Pt-Rh合金对N2的吸附力逐渐减弱 | |
| D. | 800℃以上,发生了反应:2NO(g)?O2(g)+N2(g)△H>0 |
14.下列说法正确的是( )
| A. | 甲烷与氯气取代反应的产物二氯代甲烷无同分异构体说明甲烷是正四面体结构 | |
| B. | 等物质的量的乙烷与乙酸完全燃烧消耗氧气的量相等 | |
| C. | 按系统命名法,化合物  的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| D. | 结构简式为  的化合物既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 的化合物既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 |
15.下列各组有机物只用水就鉴别的是( )
| A. | 乙醇、苯、硝基苯 | B. | 苯、己烷、溴苯 | C. | 苯、乙酸、己烯 | D. | 苯、乙醇、乙酸 |