题目内容
15.以铅蓄电池为电源,将CO2转化为乙烯的装置如图所示,电解所用电极材料均为惰性电极.下列说法不正确的是( )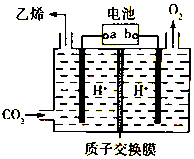
| A. | b为铅蓄电池的正极 | |
| B. | 电解过程中,阳极区溶液中c(H+)逐渐减小 | |
| C. | 阴极反应式:2CO2+12H++12e-═C2H4+4H2O | |
| D. | 每生成1mol乙烯,理论上铅蓄电池中消耗12mol硫酸 |
分析 A.根据图知,右侧电极上OH-放电生成O2,则右侧电极为阳极,左侧电极为阴极,连接电解池阴极的电极为原电池负极、连接电解池阳极的电极为原电池正极;
B.电解过程中阳极反应式为2H2O-4e-=O2↑+4H+,阳极附近有H+生成;
C.阴极上二氧化碳得电子和氢离子反应生成乙烯和水;
D.阴极反应式为2CO2+12H++12e-═C2H4+4H2O,铅蓄电池反应式为Pb+PbO2+2H2SO4 ═2PbSO4+2H2O,串联电路中转移电子相等,据此计算消耗硫酸物质的量.
解答 解:A.根据图知,右侧电极上OH-放电生成O2,则右侧电极为阳极,左侧电极为阴极,连接电解池阴极的电极为原电池负极、连接电解池阳极的电极为原电池正极,所以a为负极、b为正极,故A正确;
B.电解过程中阳极反应式为2H2O-4e-=O2↑+4H+,阳极附近有H+生成,所以电解过程中,阳极区溶液中c(H+)逐渐增大,故B错误;
C.阴极上二氧化碳得电子和氢离子反应生成乙烯和水,电极反应式为2CO2+12H++12e-═C2H4+4H2O,故C正确;
D.阴极反应式为2CO2+12H++12e-═C2H4+4H2O,铅蓄电池反应式为Pb+PbO2+2H2SO4 ═2PbSO4+2H2O,串联电路中转移电子相等,生成1mol乙烯转移12mol电子,转移2mol电子消耗2mol硫酸,所以当转移12mol电子时消耗12mol硫酸,故D正确;
故选B.
点评 本题考查原电池和电解池原理,为高频考点,明确得失电子与电解池阴阳极的关系是解本题关键,知道各个电极上电极反应式如何书写,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.新型锌-空气电池的储存电量是锂电池的三倍,成本是锂电池的一半.这种电池使用特殊材料吸附空气中的氧,电池放电时总反应:2Zn+O2+4OH-+2H2O═2Zn(OH)42-,电解液是KOH溶液.下列有关该电池的说法正确的是( )
| A. | 锌是负极,发生还原反应 | |
| B. | O2在正极发生氧化反应 | |
| C. | 工作一段时间后,电解质溶液的碱性会减弱 | |
| D. | 该电池能将化学能全部转化为电能 |
2.一定条件下,下列金属中能与水发生置换反应并产生金属氧化物的是( )
| A. | 钾 | B. | 镁 | C. | 铁 | D. | 铜 |
3.将铁粉和硫粉混合后加热,发生反应后熄灭酒精灯,反应仍然进行直到反应结束,该现象说明了( )
| A. | 铁粉的能量高于FeS | |
| B. | 铁粉和硫粉的反应常温下不能自发进行 | |
| C. | 该反应是放热反应 | |
| D. | 该反应不会产生污染物 |
10.下列有关实验的叙述正确的是( )
| A. | 将10%的葡萄糖溶液加入新制氢氧化铜悬浊液中,加热可得到砖红色沉淀 | |
| B. | 苯加入到溴水中,苯和溴发生取代反应而使溴水褪色 | |
| C. | 在洁净的试管中加入1~2 mL AgNO3溶液,再滴加稀氨水,直到AgOH完全沉淀,即制得银氨溶液 | |
| D. | 在空气中灼烧铜丝,待铜丝冷却后伸入乙醇中,反复多次,可以制得乙醛 |
5.下列各组物质含有的化学键类型完全相同的是( )
| A. | HBr、CO2、NH3 | B. | Na2O、Na2O2、Na2S | C. | NaCl、HCl、H2O | D. | NaOH、CaCl2 CaO |
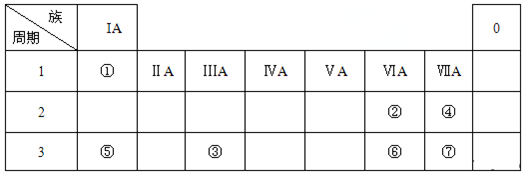
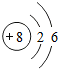 ,b的最简单氢化物的电子式为
,b的最简单氢化物的电子式为 .
.