题目内容
6.Zn-ZnSO4-PbSO4-Pb电池装置如图,下列说法错误的是( )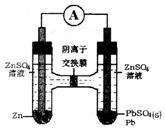
| A. | SO42-从右向左迁移 | |
| B. | 电池的正极反应为:Pb2++2e-═Pb | |
| C. | 左边ZnSO4浓度增大,右边ZnSO4浓度不变 | |
| D. | 若有6.5g锌溶解,有0.1 molSO42-通过离子交换膜 |
分析 据Zn-ZnSO4-PbSO4-Pb电池装置图可知,此原电池中锌活泼为负极失电子发生氧化反应,Pb为正极得电子发生还原反应,阴离子移向负极,据此分析.
解答 解:A、阴离子移向负极,则SO42-从右正极向左负极迁移,故A正确;
B、Pb为正极得电子发生还原反应,反应为:PbSO4+2e-═Pb+SO42-,故B错误;
C、左边锌为负极失电子发生氧化反应,反应为:Zn-2e-═Zn2+,右边Pb为正极得电子发生还原反应,反应为PbSO4+2e-═Pb+SO42-,SO42-从右正极向左负极迁移,所以左边ZnSO4浓度增大,右边ZnSO4浓度不变,故C正确;
D、根据负极反应Zn-2e-═Zn2+,则有6.5g即0.1mol锌溶解,根据电荷守恒则有0.1 molSO42-通过离子交换膜,故D正确;
故选B.
点评 本题考查原电池原理,明确正负极得判断及其反应是解本题的关键,难度不大.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
16.用20mL18.4mol•L-1的浓硫酸与铜共热一段时间后,冷却,过滤除去多余的铜,将滤液稀释到100mL,得到溶液中SO42-的浓度为3.18mol•L-1,则此时溶液中CuSO4的物质的量浓度为( )
| A. | 0.50mol•L-1 | B. | 0.75mol•L-1 | C. | 1.00mol•L-1 | D. | 3.18mol•L-1 |
17.硫酸、亚硫酸和氢硫酸是含硫的三种酸.下列说法不正确的是( )
| A. | 若向Na2S溶液中通入SO2则产生淡黄色沉淀 | |
| B. | 这三种酸都是二元酸,都能与氢氧化钠反应生成酸式盐和正盐 | |
| C. | 这三种酸的水溶液久置空气中都会变质 | |
| D. | 向氢硫酸、亚硫酸溶液中滴加氯水都会发生氧化还原反应 |
14.下列离子方程式不正确的是( )
| A. | 乙醛与银氨溶液反应:CH3CHO+2[Ag(NH3)2]OH $\stackrel{△}{→}$CH3COO-+NH4++2Ag↓+3NH3+H2O | |
| B. | 醋酸溶液与新制氢氧化铜反应:2CH3COOH+Cu(OH)2→Cu2++2CH3COO-+2H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| D. | 溴乙烷水解生成乙醇:CH3CH2Br+OH-$→_{△}^{H_{2}O}$CH3CH2OH+Br- |
1.新型锌-空气电池的储存电量是锂电池的三倍,成本是锂电池的一半.这种电池使用特殊材料吸附空气中的氧,电池放电时总反应:2Zn+O2+4OH-+2H2O═2Zn(OH)42-,电解液是KOH溶液.下列有关该电池的说法正确的是( )
| A. | 锌是负极,发生还原反应 | |
| B. | O2在正极发生氧化反应 | |
| C. | 工作一段时间后,电解质溶液的碱性会减弱 | |
| D. | 该电池能将化学能全部转化为电能 |
11.为实现实验目的,选用的装置、实验操作均正确的是( )
| 实验目的 | 实验步骤和装置 | |
| A | 探究温度对反应速率的影响 | 不同温度下,分别取同体积0.1mol•L-1KI溶液,向其中匀先加入淀粉溶液3滴,再各加入0.1mol•L-1硫酸5滴,并同时记录溶液出现蓝色的时间 |
| B | 配制100mL1.0mol•L-1NaOH溶液 | 向100mL容量瓶中加入4.0gNaOH固体,加水到刻度线 |
| C | 验证牺牲阳极的阴极保护法 | 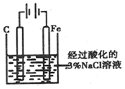 往铁电极附近滴加铁氯化钾溶液 |
| D | 比较H2O2和Fe3+的氧化性 | 将盐酸酸化的双氧水滴入Fe(NO3)2溶液中 |
| A. | A | B. | B | C. | C | D. | D |
18.下列实验操作或装置中的药品使用正确的是( )
| A. |  配制溶液 | B. |  证明非金属性强弱:C>Si | ||
| C. |  除去CO2中的HCl | D. |  证明SO2有漂白性 |
15.紫苏醇可抑制肿瘤发生,其结构简式如图,下列有关紫苏醇的叙述正确的是( )
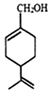

| A. | 分子式为C10H16O | |
| B. | 紫苏醇为芳香族化合物 | |
| C. | 环上的一氯取代物有四种 | |
| D. | 使酸性高锰酸钾溶液和溴水褪色的原理相同 |