题目内容
4.通常状态下,在100mL的针筒里充有80ml的氯气,观察针筒里的现象是针筒里充满黄绿色的气体;铁在氯气中剧烈燃烧的产物在水溶液中的电离方程式:FeCl3=Fe3++3Cl-.分析 氯气溶液呈浅黄绿色,铁与氯气剧烈燃烧的产物是氯化铁,氯化铁水溶液电离出氯离子和铁离子,由此分析解答.
解答 解:通常状态下,在100mL的针筒里充有80ml的氯气,现象是针筒里充满黄绿色的气体,铁与氯气剧烈燃烧的产物是氯化铁,氯化铁水溶液电离出氯离子和铁离子,离子方程式为:FeCl3=Fe3++3Cl-,故答案为:针筒里充满黄绿色的气体;FeCl3=Fe3++3Cl-.
点评 本题考查氯气的性质,侧重于平衡移动的考查,注意把握氯气的性质,有利于培养学生的良好科学素养,难度不大,注意相关基础知识的积累.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
14.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 常温常压下,80g SO3含有的氧原子数为3NA | |
| B. | 物质的量浓度为0.5 mol•L-1 的MgCl2溶液,含有的Cl- 数目为0.5NA | |
| C. | 常温常压下,22.4L H2中所含原子数为2NA | |
| D. | 标准状况下,22.4L水中所含的分子数为NA |
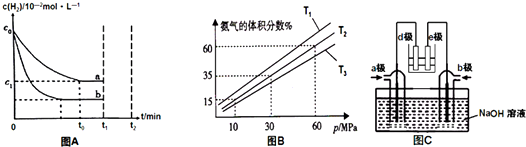
15.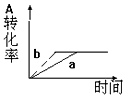 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H<0,图中曲线a 代表一定条件下该反应的过程,若使a曲线变为b曲线,可采用的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H<0,图中曲线a 代表一定条件下该反应的过程,若使a曲线变为b曲线,可采用的措施是( )
 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H<0,图中曲线a 代表一定条件下该反应的过程,若使a曲线变为b曲线,可采用的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H<0,图中曲线a 代表一定条件下该反应的过程,若使a曲线变为b曲线,可采用的措施是( )| A. | 增大A的浓度或减少C的浓度 | B. | 缩小容器的容积或加入催化剂 | ||
| C. | 升高温度或增大压强 | D. | 升高温度 |
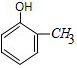 2-甲基苯酚、
2-甲基苯酚、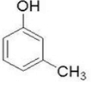 3-甲基苯酚、
3-甲基苯酚、 4-甲基苯酚.
4-甲基苯酚.
 在实验室,可以用如图所示的装置制取乙酸乙酯.请回答下列问题:
在实验室,可以用如图所示的装置制取乙酸乙酯.请回答下列问题: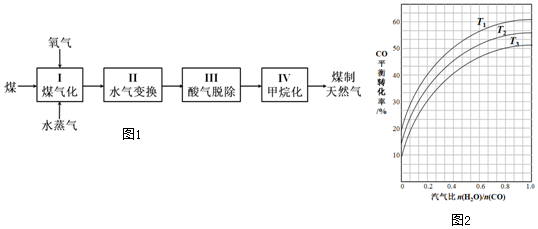 ②
②