题目内容
6.煤制天然气工艺是煤高效洁净利用的新途径之一,其工艺流程简如图1如下: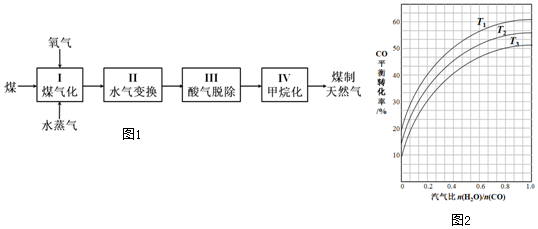 ②
②(1)反应I:C(s)+H2O(g)?CO(g)+H2(g)△H=+135kJ•mol-1,通入的氧气会与部分碳发生燃烧反应.请利用能量转化及平衡移动原理说明通入氧气的作用:氧气与碳发生燃烧反应放热,放出的热被可逆反应C(s)+H2O(g)?CO(g)+H2(g)吸收利用,促进反应正向移动.
(2)反应II:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ•mol-1.如图2表示不同温度条件下,煤气化反应I发生后的汽气比(水蒸气与原料气中CO物质的量之比)与CO平衡转化率的变化关系.
①判断T1、T2和T3的大小关系:T1<T2<T3.
②若煤气化反应I发生后的汽气比为0.8,经煤气化反应I和水气变换反应II后,得到CO与H2的物质的量之比为1:3,则反应II应选择的温度是T3(填“T1”“T2”或“T3”).
(3)①甲烷化反应IV发生之前需要进行脱酸反应III.煤经反应I和II后的气体中含有两种酸性气体,分别是H2S和CO2.
②工业上常用热碳酸钾法脱除H2S气体得到两种酸式盐,该反应的化学方程式是K2CO3+H2S═KHS+KHCO3.
(4)已知:
CO(g)+H2O(g)?CO2(g)+H2(g)△H1=-41kJ•mol-1
2H2(g)+O2(g)?2H2O(g)△H2=-484kJ•mol-1
CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H3=-802kJ•mol-1
反应IV:CO(g)+3H2(g)?CH4(g)+H2O(g)△H=-207kJ•mol-1.
分析 (1)C(s)+H2O(g)?CO(g)+H2(g)△H=+135kJ•mol-1,是吸热反应,而碳与氧气反应放出热量,升高温度平衡向吸热方向移动;
(2)①反应CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ•mol-1的正反应为放热反应,升高温度平衡逆向移动;
②若煤气化反应I发生后的汽气比为0.8,设水蒸气的物质的量是4mol、则生成的CO物质的量为5mol,同时生成5mol氢气,经煤气化反应I和水气变换反应II后,设反应II中CO转化的为xmol,则生成xmol氢气,则(5-x):(5+x)=1:3,x=2.5,CO的转化率=$\frac{2.5mol}{5mol}$×100%=50%,据此判断反应温度;
(3)①根据方程式II知,生成的酸性气体还有二氧化碳;
②工业上常用热碳酸钾法脱除H2S气体得到两种酸式盐,则二者反应生成碳酸氢钾和硫氢化钾;
(4)CO(g)+H2O(g)?CO2(g)+H2(g)△H1=-41kJ•mol-1①
2H2(g)+O2(g)?2H2O(g)△H2=-484kJ•mol-1②
CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H3=-802kJ•mol-1③
将方程式①+2②-③得反应IV:CO(g)+3H2(g)?CH4(g)+H2O(g)△H 进行相应的改变.
解答 解:(1)C(s)+H2O(g)?CO(g)+H2(g)△H=+135kJ•mol-1,是吸热反应,而碳与氧气反应放出热量,使反应C(s)+H2O(g)?CO(g)+H2(g),向正反应方向移动,提高碳的利用率,
故答案为:氧气与碳发生燃烧反应放热,放出的热被可逆反应C(s)+H2O(g)?CO(g)+H2(g)吸收利用,促进反应正向移动;
(2)①反应CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ•mol-1的正反应为放热反应,温度越高一氧化碳的转化率越低,由图可知,温度的大小为:T1<T2<T3,故答案为:T1<T2<T3;
②若煤气化反应I发生后的汽气比为0.8,设水蒸气的物质的量是4mol、则生成的CO物质的量为5mol,同时生成5mol氢气,经煤气化反应I和水气变换反应II后,设反应II中CO转化的为xmol,则生成xmol氢气,则(5-x):(5+x)=1:3,x=2.5,CO的转化率=$\frac{2.5mol}{5mol}$×100%=50%,根据图知,反应温度为T3,
故答案为:T3;
(3)①根据方程式II知,生成的酸性气体还有二氧化碳,故答案为:CO2;
②工业上常用热碳酸钾法脱除H2S气体得到两种酸式盐,则二者反应生成碳酸氢钾和硫氢化钾,反应方程式为K2CO3+H2S═KHS+KHCO3,
故答案为:K2CO3+H2S═KHS+KHCO3;
(4)CO(g)+H2O(g)?CO2(g)+H2(g)△H1=-41kJ•mol-1 ①
2H2(g)+O2(g)?2H2O(g)△H2 =-484kJ•mol-1 ②
CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H3=-802kJ•mol-1 ③
将方程式①+2②-③得反应IV:CO(g)+3H2(g)?CH4(g)+H2O(g)△H=△H1+2△H2-△H3=(-41kJ•mol-1)+2(-484kJ•mol-1 )-(-802kJ•mol-1)=-207 kJ•mol-1,
故答案为:-207 kJ•mol-1.
点评 本题考查化学平衡计算、盖斯定律、化学平衡影响因素等知识点,侧重考查学生图象分析、判断及计算能力,难点是(2)②题温度判断,要结合CO转化率确定反应温度,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 用蒸发水分的方法使海水中的盐析出 | |
| B. | 用加热蒸馏的方法,从工业酒精中获得95.6%的乙醇 | |
| C. | 用加热升华的方法把单质碘从它和碘化钾固体形成的混合物中分离出来 | |
| D. | 用加热的方法,把掺杂在NaCl固体中的少量NH4HCO3固体除去 |
| 选项 | 实验操作、现象 | 结论 |
| A | 某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体;另取原溶液少许,向其中滴加CaCl2溶液,有白色沉淀生成 | 确定该溶液存在CO32- |
| B | 氯水中存在多种分子和离子,向新制氯水中加入有色布条,片刻后有色布条褪色 | 说明氯水中有HClO存在 |
| C | 将淀粉与KCl混合液装于半透膜内,浸泡在盛蒸馏水的烧杯中,5min后取烧杯中液体,加碘水变蓝色 | 证明半透膜有破损 |
| D | 将气体通入盛饱和碳酸钠溶液的洗气瓶 | 可用于除去中CO2的HCl |
| A. | A | B. | B | C. | C | D. | D |
| A. | 西瓜是酸性食物 | B. | 猪肉、牛肉是碱性食物 | ||
| C. | 巧克力、奶油是酸性食物 | D. | 大米、面粉是碱性食物 |
| A. | 光照射甲烷和氯气的混合气体 | |
| B. | 乙烯通入溴水中 | |
| C. | 在镍作催化剂条件下,苯与氢气反应 | |
| D. | 苯与液溴混合后撒入铁粉 |
| A. | 将lL2mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA | |
| B. | 1L0.1mol/LNaHSO4溶液中含有0.1 Na个HSO4- | |
| C. | 常温常压下,23gNO2和N2O4的混合气体一定含有NA个氧原子 | |
| D. | lmol铁与足量稀盐酸反应转移的电子数目为3NA |