题目内容
下列反应中,水只作氧化剂的是( )
| A、2F2+2H2O=4HF+O2 | ||||
| B、2Na+2H2O=2NaOH+H2↑ | ||||
C、2H2O
| ||||
| D、Na2O+H2O=2NaOH |
考点:氧化还原反应
专题:
分析:水中H元素的化合价降低作氧化剂,水中O元素化合价升高,作还原剂,结合发生的化学反应分析水不是作氧化剂,以此来解答.
解答:
解:A.2F2+2H2O=4HF+O2反应中水中O元素的化合价升高,是作还原剂,故A不选;
B.2Na+2H2O=2NaOH+H2↑,Na元素的化合价升高,水中H元素化合价降低,水作氧化剂,故B选;
C.2H2O
2H2↑+O2↑水中H元素化合价降低,O元素的化合价升高,水作氧化剂,又作还原剂,故C不选;
D.Na2O+H2O=2NaOH反应中没有化合价的变化,不是氧化还原反应,故D不选;
故选B.
B.2Na+2H2O=2NaOH+H2↑,Na元素的化合价升高,水中H元素化合价降低,水作氧化剂,故B选;
C.2H2O
| ||
D.Na2O+H2O=2NaOH反应中没有化合价的变化,不是氧化还原反应,故D不选;
故选B.
点评:本题考查氧化还原反应,侧重氧化剂判断的考查,把握反应中元素的化合价变化为解答的关键,题目难度不大.

练习册系列答案
相关题目
在 1L K2SO4、CuSO4的混合溶液中,c(SO42-)=2mol?L-1,用石墨作电极电解此溶液,当通电一段时间后(电解完全),两极均收集到22.4L气体(标准状况),原溶液中c(K+)为( )
| A、0.5 mol?L-1 |
| B、1 mol?L-1 |
| C、1.5 mol?L-1 |
| D、2 mol?L-1 |
已知常温下在溶液中可发生如下两个离子反应:①Ce4++Fe2+=Fe3++Ce3+②Sn2++2Fe3+=2Fe2++Sn4+ 下列说法正确的是( )
| A、反应②中的被还原与被氧化的离子的个数之比是1:2 |
| B、反应②中每2mol Fe3+参加反应转移1mol电子 |
| C、氧化性:Ce4+>Fe3+>Sn4+ |
| D、还原性:Fe2+>Ce3+>Sn2+ |
邻苯二甲醛(X)在碱性条件下发生歧化(即自身氧化还原)反应,再经酸化得到化合物Y.Y可在浓硫酸存在的条件下生成含五元环的化合物Z.则下列说法正确的是( )
| A、邻二甲苯不可用作生产X的原料 |
| B、Y可发生银镜反应 |
| C、Y可与FeCl3发生显色反应 |
| D、Z与X的相对分子质量相等 |
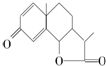 是一种驱虫药--山道年的结构简式,试确定其分子式为
是一种驱虫药--山道年的结构简式,试确定其分子式为