题目内容
已知常温下在溶液中可发生如下两个离子反应:①Ce4++Fe2+=Fe3++Ce3+②Sn2++2Fe3+=2Fe2++Sn4+ 下列说法正确的是( )
| A、反应②中的被还原与被氧化的离子的个数之比是1:2 |
| B、反应②中每2mol Fe3+参加反应转移1mol电子 |
| C、氧化性:Ce4+>Fe3+>Sn4+ |
| D、还原性:Fe2+>Ce3+>Sn2+ |
考点:氧化还原反应
专题:氧化还原反应专题
分析:反应Ce4++Fe2+=Fe3++Ce3+中Ce元素化合价降低,Fe元素化合价升高,反应Sn2++2Fe3+=2Fe2++Sn4+中,Fe元素化合价降低,Sn元素化合价升高,氧化还原反应中,还原剂的还原性强于还原产物的还原性,氧化剂的氧化性大于氧化产物的氧化性,以此解答该题.
解答:
解:A.由化合价的变化可知,反应②中,Fe元素化合价降低,被还原,Sn元素化合价升高,被氧化,被还原与被氧化的离子的个数之比是2:1,故A错误;
B.Fe元素化合价由+3价降低到+2价,反应②中每2mol Fe3+参加反应转移2mol电子,故B错误;
C.氧化剂的氧化性大于氧化产物的氧化性,由反应①可知氧化性Ce4+>Fe3+,由②可知氧化性Fe3+>Sn4+,则Ce4+>Fe3+>Sn4+,故C正确;
D.还原剂的还原性强于还原产物的还原性,由两个反应可知还原性Sn2+>Fe2+>Ce3+,故D错误.
故选C.
B.Fe元素化合价由+3价降低到+2价,反应②中每2mol Fe3+参加反应转移2mol电子,故B错误;
C.氧化剂的氧化性大于氧化产物的氧化性,由反应①可知氧化性Ce4+>Fe3+,由②可知氧化性Fe3+>Sn4+,则Ce4+>Fe3+>Sn4+,故C正确;
D.还原剂的还原性强于还原产物的还原性,由两个反应可知还原性Sn2+>Fe2+>Ce3+,故D错误.
故选C.
点评:本题综合考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,注意把握比较氧化性、还原性的角度,难度不大.

练习册系列答案
相关题目
已知苯和一卤代烷在催化剂的作用下可生成苯的同系物: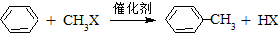 在催化剂的作用下,由苯和下列各组物质合成乙苯,最好应选用的是( )
在催化剂的作用下,由苯和下列各组物质合成乙苯,最好应选用的是( )
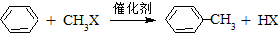 在催化剂的作用下,由苯和下列各组物质合成乙苯,最好应选用的是( )
在催化剂的作用下,由苯和下列各组物质合成乙苯,最好应选用的是( )| A、CH3CH3和Cl |
| B、CH2=CH2和Cl2 |
| C、CH2=CH2和HCl |
| D、CH3CH3和HCl |
下列反应中,水只作氧化剂的是( )
| A、2F2+2H2O=4HF+O2 | ||||
| B、2Na+2H2O=2NaOH+H2↑ | ||||
C、2H2O
| ||||
| D、Na2O+H2O=2NaOH |
 某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质,在反应过程中测得ClO和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质,在反应过程中测得ClO和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )| A、还原剂是CN-,氧化产物只有N2 |
| B、氧化剂是ClO-,还原产物是HCO3- |
| C、配平后氧化剂与还原剂的计量系数之比为5:2 |
| D、标准状况下若生成2.24LN2,则转移电子0.5 mol |
某烷烃主链上有4个碳原子的同分异构体有2种,该烷烃的碳原子数可能有( )
| A、6个 | B、4个 | C、5个 | D、8个 |
用NA代表阿伏加德罗常数,下列说法正确的是( )
| A、物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1 NA |
| B、标准状况下,11.2 L H2O 所含的分子数为0.5NA |
| C、常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
| D、18g H2O 和H2O2 的混合物含有的分子数为1NA |
一定温度和压强下,24.5L某种气态纯净物中含有6.02×1023个分子,这些分子由1.204×1024个原子组成,下列有关说法中不正确的是( )
| A、标准状况下该纯净物若为气态,其体积约是22.4 L |
| B、该气体中每个分子含有2个原子 |
| C、若O2在该条件下为气态,则1 mol O2在该条件下的体积也为24.5 L |
| D、该温度和压强可能是标准状况 |