题目内容
雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一.消除氮氧化物和硫氧化物有多种方法.
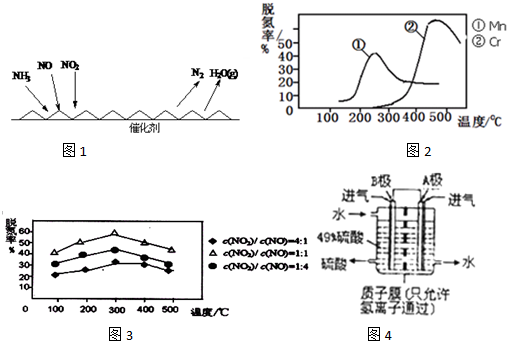
(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.反应原理如图1所示:
①由如图2可知SCR技术中的氧化剂为 .
②图3是不同催化剂Mn和Cr在不同温度下对应的脱氢率,由图可知最佳的催化剂和相应的温度分别为: .
③用Fe做催化剂时,在氨气足量的情况下,不同c(NO2)/c(NO)对应的脱氢率如图4所示,脱氢效果最佳的
= .已知生成1molN2反应放出的热量为QkJ,此时对应的脱氢反应的热化学方程式为 .
(2)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.
已知:H2(g)+
O2(g)═H2O(g)△H1=-241.8kJ?mol-1
C(s)+
O2(g)═CO(g)△H2=-110.5kJ?mol-1
则焦炭与水蒸气反应生成CO的热化学方程式为 .
②用SO2和O2制备硫酸,装置如图4所示,电极为多孔材料,能吸附气体,同时也能使气体与电解质溶液充分接触,B极的电极反应式为 .

(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.反应原理如图1所示:
①由如图2可知SCR技术中的氧化剂为
②图3是不同催化剂Mn和Cr在不同温度下对应的脱氢率,由图可知最佳的催化剂和相应的温度分别为:
③用Fe做催化剂时,在氨气足量的情况下,不同c(NO2)/c(NO)对应的脱氢率如图4所示,脱氢效果最佳的
| c(NO2) |
| c(NO) |
(2)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.
已知:H2(g)+
| 1 |
| 2 |
C(s)+
| 1 |
| 2 |
则焦炭与水蒸气反应生成CO的热化学方程式为
②用SO2和O2制备硫酸,装置如图4所示,电极为多孔材料,能吸附气体,同时也能使气体与电解质溶液充分接触,B极的电极反应式为
考点:常见的生活环境的污染及治理
专题:基本概念与基本理论
分析:(1)①得电子化合价降低的反应物是氧化剂;
②温度越高,对设备的要求越高,所以如果催化剂在较低温度下能较大程度的脱氢即可;
③根据纵坐标判断,相同温度下,脱氢率越高的效果越好;生成1mol氮气放出QkJ热量,则生成2mol氮气放出2QkJ热量;
(2)①利用盖斯定律,通过已知热化学方程式运算得目标热化学方程式;
②本题为SO2与O2反应生成SO3,SO3再与水化合生成硫酸,根据硫酸的出口判断正负极,负极发生氧化反应,正极发生还原反应;
②温度越高,对设备的要求越高,所以如果催化剂在较低温度下能较大程度的脱氢即可;
③根据纵坐标判断,相同温度下,脱氢率越高的效果越好;生成1mol氮气放出QkJ热量,则生成2mol氮气放出2QkJ热量;
(2)①利用盖斯定律,通过已知热化学方程式运算得目标热化学方程式;
②本题为SO2与O2反应生成SO3,SO3再与水化合生成硫酸,根据硫酸的出口判断正负极,负极发生氧化反应,正极发生还原反应;
解答:
解:(1)①根据图象知,反应物是NO、NO2和NH3,生成物是N2和H2O,氮氧化物中N元素化合价由正化合价变为0价、氨气中N元素化合价由-3价变为0价,所以氧化剂是NO、NO2,故答案为:NO、NO2;
②根据图象知,脱氢率越高越好,但Cr作催化剂时温度高于Mn,温度越高,对设备要求越高,增大生产成本,且脱氢率增大较小,所以使用Mn作催化剂较好;根据图象知,在温度为200-250℃或范围内间任意温度,脱氢率较高,故答案为:Mn;200-250℃或范围内间任意温度;
③根据纵坐标判断,相同温度下,脱氢率越高的效果越好,所以其比值为1:1时最好;生成1mol氮气放出QkJ热量,则生成2mol氮气放出2QkJ热量,则其热化学反应方程式为2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O(g)△H=-2QkJ/mol,
故答案为:1:1;2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O(g)△H=-2QkJ/mol;
(2)①H2(g)+
O2(g)═H2O(g)△H1=-241.8kJ?mol-1①
C(s)+
O2(g)═CO(g)△H2=-110.5kJ?mol-1②
利用盖斯定律将方程式变形:②-①得 C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol,
故答案为:C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol;
②该原电池中,负极上失电子被氧化,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,正极上投放的气体是氧气,正极上氧气得电子和氢离子反应生成水,根据硫酸和水的出口方向知,B极是负极,A极是正极,所以B极上的电极反应式为:SO2-2e-+2H2O═SO42-+4H+,故答案为:SO2-2e-+2H2O═SO42-+4H+.
②根据图象知,脱氢率越高越好,但Cr作催化剂时温度高于Mn,温度越高,对设备要求越高,增大生产成本,且脱氢率增大较小,所以使用Mn作催化剂较好;根据图象知,在温度为200-250℃或范围内间任意温度,脱氢率较高,故答案为:Mn;200-250℃或范围内间任意温度;
③根据纵坐标判断,相同温度下,脱氢率越高的效果越好,所以其比值为1:1时最好;生成1mol氮气放出QkJ热量,则生成2mol氮气放出2QkJ热量,则其热化学反应方程式为2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O(g)△H=-2QkJ/mol,
故答案为:1:1;2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O(g)△H=-2QkJ/mol;
(2)①H2(g)+
| 1 |
| 2 |
C(s)+
| 1 |
| 2 |
利用盖斯定律将方程式变形:②-①得 C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol,
故答案为:C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol;
②该原电池中,负极上失电子被氧化,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,正极上投放的气体是氧气,正极上氧气得电子和氢离子反应生成水,根据硫酸和水的出口方向知,B极是负极,A极是正极,所以B极上的电极反应式为:SO2-2e-+2H2O═SO42-+4H+,故答案为:SO2-2e-+2H2O═SO42-+4H+.
点评:本题重点考查图象的分析、热化学反应方程式的书写、原电池原理,注意原电池放电时,负极发生氧化反应,为易错点.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
下列反应中,水只作氧化剂的是( )
| A、2F2+2H2O=4HF+O2 | ||||
| B、2Na+2H2O=2NaOH+H2↑ | ||||
C、2H2O
| ||||
| D、Na2O+H2O=2NaOH |
某烷烃主链上有4个碳原子的同分异构体有2种,该烷烃的碳原子数可能有( )
| A、6个 | B、4个 | C、5个 | D、8个 |
用NA代表阿伏加德罗常数,下列说法正确的是( )
| A、物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1 NA |
| B、标准状况下,11.2 L H2O 所含的分子数为0.5NA |
| C、常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
| D、18g H2O 和H2O2 的混合物含有的分子数为1NA |
X、Y、Z是短周期的三种主族元素,在周期表中的相对位置如图所示,下列说法正确的是( )


| A、原子半径:X<Y<Z |
| B、X、Y、Z三种元素的最高价氧化物对应水化物中最多有一种强酸 |
| C、X的气态氢化物的稳定性比Y的气态氢化物强 |
| D、常温下X、Y、Z的单质不可能均与盐酸反应 |
往4.5mL的某AgNO3溶液中加入一定量pH=1的盐酸,恰好将溶液中的Ag+完全沉淀,加水稀释,得到pH=2的溶液50.0mL,则该AgNO3溶液的浓度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|