题目内容
20.氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节.回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是污染小、可再生、来源广、资源丰富、燃烧热值高(至少答出两点).
但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:H2+2OH--2e-=2H2O.
(2)氢气可用于制备H2O2.已知:
H2(g)+A(l)═B(l)△H1
O2(g)+B(l)═A(l)+H2O2(l)△H2
其中A、B为有机物,两反应均为自发反应,则H2(g)+O2(g)═H2O2(l)的△H=<0(填“>”或“=”)
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)?MHx+2y(s)△H<0达到化学平衡.下列有关叙述正确的是ac
a.容器内气体压强保持不变
b.吸收ymol H2只需1mol MHx
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为将光能转化为化学能.
(5)化工生产的副产氢也是氢气的来源,电解法制取有广泛用途的Na2FeO4.同时获得氢气:Fe+2H2O+2OH-→FeO42-+3H2↑,装置如图所示,装置通电后,铁电极附近生成紫红色FeO42-,镍电极有气泡产生.若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质.已知:Na2FeO4只在强碱性条件下稳定,易被H2还原.
①电解一段时间后,c(OH-)降低的区域在阳极室(填“阴极室”或“阳极室”).
②电解过程中,须将阴极产生的气体及时排出,其原因为防止Na2FeO4与H2反应使产率降低.
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因M点:c(OH-)低,Na2FeO4稳定性差,且反应慢(或N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低).
分析 (1)与汽油相比,氢气作为燃料的优点有污染小、可再生、来源广、资源丰富、燃烧热值高等;碱性氢氧燃料电池的负极反应式为H2+2OH--2e-=2H2O;
(2)①H2(g)+A(l)=B(l)△H1,②O2(g)+B(l)=A(l)+H2O2(l)△H2,两反应的△S<0,根据△G=△H-T△S,因为均为两反应自发反应,因此△H均小于0,将①+②得:H2(g)+O2(g)=H2O2(l)的△H=△H1+△H1<0;
(3)MHx(s)+yH2(g)?MHx+2y(s)△H<0,该反应属于气体的物质的量发生变化的反应,a.平衡时气体的物质的量不变,容器内气体压强保持不变;b.该反应为可逆反应,不能完全转化,吸收ymol H2需大于1mol MHx;c.若降温,平衡正向移动,该反应的平衡常数增大;d.若向容器内通入少量氢气,相当于增大压强,平衡正向移动,则v(放氢)<v(吸氢);
(4)利用太阳能直接分解水制氢,是将光能转化为化学能;
(5)①根据题意镍电极有气泡产生是氢离子放电生成氢气,铁电极发生氧化反应,溶液中的氢氧根离子减少;
②氢气具有还原性,根据题意Na2FeO4只在强碱性条件下稳定,易被H2还原.电解过程中,须将阴极产生的气体及时排出,防止Na2FeO4与H2反应使产率降低;
③根据题意Na2FeO4只在强碱性条件下稳定,在M点,c(OH-)低,Na2FeO4稳定性差,且反应慢,在N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低.
解答 解:(1)与汽油相比,氢气作为燃料的优点有污染小、可再生、来源广、资源丰富、燃烧热值高等;碱性氢氧燃料电池的负极反应式为H2+2OH--2e-=2H2O,
故答案为:污染小、可再生、来源广、资源丰富、燃烧热值高;H2+2OH--2e-=2H2O;
(2)①H2(g)+A(l)=B(l)△H1,②O2(g)+B(l)=A(l)+H2O2(l)△H2,两反应的△S<0,根据△G=△H-T△S,因为均为两反应自发反应,因此△H均小于0,将①+②得:H2(g)+O2(g)=H2O2(l)的△H=△H1+△H2<0,
故答案为:<;
(3)MHx(s)+yH2(g)?MHx+2y(s)△H<0,该反应属于气体的物质的量发生变化的反应,a.平衡时气体的物质的量不变,容器内气体压强保持不变,正确;b.该反应为可逆反应,不能完全转化,吸收ymol H2需大于1mol MHx,错误;c.若降温,平衡正向移动,该反应的平衡常数增大,正确;d.若向容器内通入少量氢气,相当于增大压强,平衡正向移动,则v(放氢)<v(吸氢),错误;
故选ac;
(4)利用太阳能直接分解水制氢,是将光能转化为化学能,
故答案为:将光能转化为化学能;
(5)①根据题意镍电极有气泡产生是氢离子放电生成氢气,铁电极发生氧化反应,溶液中的氢氧根离子减少,因此电解一段时间后,c(OH-)降低的区域在阳极室,
故答案为:阳极室;
②氢气具有还原性,根据题意Na2FeO4只在强碱性条件下稳定,易被H2还原.电解过程中,须将阴极产生的气体及时排出,防止Na2FeO4与H2反应使产率降低,
故答案为:防止Na2FeO4与H2反应使产率降低;
③根据题意Na2FeO4只在强碱性条件下稳定,在M点,c(OH-)低,Na2FeO4稳定性差,且反应慢,在N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低,
故答案为:M点:c(OH-)低,Na2FeO4稳定性差,且反应慢(或N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低).
点评 本题主要考查了化学反应中的能量变化、化学平衡状态的判断、电解原理及其应用的相关知识,题目难度中等.

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案| A. | K2FeO4是新型水处理剂,其原理与明矾相同 | |
| B. | 煤的气化是物理变化,是高效、清洁地利用煤的重要途径 | |
| C. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 | |
| D. | 纯银器在空气中久置变黑是因为发生了电化学腐蚀 |
| A. | 溴水 | B. | 酸性高锰酸钾溶液 | ||
| C. | 苛性钠溶液 | D. | 四氯化碳溶液 |
| 配0.1mol/L的标准盐酸和0.01mol•L-1的标准盐酸 | → | 用0.1mol•L-1的标准盐酸滴定未知Ba(OH)2溶液10mL用去盐酸19.60mL | → | 用Ba(OH)2溶液吸收10L空气中的CO2(标准状况) | → | 过 滤 | → | 取滤液20mL,用0.01mol•L-1的盐酸滴定用去盐酸34.8mL |
①托盘天平 ②容量瓶 ③滴定管 ④量筒 ⑤烧杯 ⑥胶头滴管 ⑦玻璃棒
A、①②⑤⑥B、②④⑤⑥⑦C、①②⑥⑦D、②④⑤⑥
(2)滴定操作时,左手控制酸式滴定管活塞,眼睛注视液滴下滴速度和锥形瓶中溶液颜色的变化;
(3)取上述Ba(OH)2溶液10mL放入100mL容量瓶中,加水稀释至刻度,把稀释后的溶液放入密闭容器,并引入10L空气,振荡,过滤.需过滤的原因是除去BaCO3沉淀,使滤液只含Ba(OH)2,以保证实验成功;
(4)①本实验中,用0.1mol•L-1的标准盐酸滴定未知Ba(OH)2溶液时,由于操作不当,滴定结束后滴定管尖嘴处有一气泡,则实际用去盐酸大于19.60mL(填大于、小于、等于)
②若滴定Ba(OH)2溶液时使用的酸式滴定管未经处理,即换0.01mol•L-1盐酸溶液进行第二次滴定,导致算出空气中CO2值(填偏高、偏低或无影响)偏低.
(5)由实验数据算出空气中CO2的体积分数为0.025%.
| A. | 常温常压下,16g 14CH4所含中子数目为8NA | |
| B. | 标准状况下,22.4 L CCl4所含分子数目为NA | |
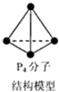
| C. | 6.2g白磷(分子式为P4,分子结构如图所示)所含P-P键数目为0.3NA | |
| D. | 1mol含8个碳原子的某烃分子,最多形成8NA个碳碳单键 |
| 单质 | a | b | c | d | e |
| 沸点(℃) | 58.8 | 882.9 | 444.7 | 2 355 | 1 107 |
(2)写出d的元素原子的最外层电子排布式3s23p2;其元素原子核外中共有5种能量不同的电子;
(3)写出c的气态氢化物的水溶液与b的元素的最高价氧化物对应水化物反应的离子方程式H2S+2OH-=S 2-+H2O.
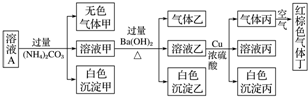
下列有关说法正确的是( )
| A. | 该溶液中一定有NO3-、Al3+、SO42-、Cl-四种离子 | |
| B. | 实验最多消耗Cu 1.92g,生成气体丙在标准状态下体积为448mL | |
| C. | 沉淀乙一定有BaCO3,可能有BaSO4 | |
| D. | 为确定原溶液中是否有Na+、K+,可通过焰色反应来确定 |