题目内容
2.下列说法中正确的是( )| A. | 铅蓄电池在充电过程中,正、负极质量都增大 | |
| B. | 反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的△H<0 | |
| C. | NH3•H2O溶液加水稀释后,溶液中$\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$的值减小 | |
| D. | 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 |
分析 A、铅蓄电池在充电过程中,正是硫酸铅氧化成二氧化铅、负极是硫酸铅还原成单质铅;
B、反应能否自发进行,决定于有△H-T△S;
C、加水稀释促进氨水的电离,所以一水合的浓度减少,铵根离子的浓度增大;
D、盐酸抑制了水的电离,氯化铵中铵离子促进了水的电离;
解答 解:A、铅蓄电池在充电过程中,正是硫酸铅氧化成二氧化铅、负极是硫酸铅还原成单质铅,所以质量都减小,故A错误;
B、反应物中有气体,生成物中没有气体,故△S<0,若要使反应自发进行,△H-T△S<0,则△H必须小于0,故B正确;
C、加水稀释促进氨水的电离,所以一水合的浓度减少,铵根离子的浓度增大,则溶液中$\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$的值减小,故C正确;
D、盐酸抑制了水的电离,而氯化铵溶液中铵离子水解,促进了水的电离,所以两溶液中水的电离程度不相同,故D错误;
故选BC.
点评 本题考查了铅蓄电池的充电原理、反应的自发性、水的电离平衡等知识,题目难度中等,注意酸溶液和碱溶液抑制了水的电离,而能够水解的盐能够促进水的电离.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
9.如表是Na、Mg、Si、S、Br五种元素的单质的沸点,其中b、e均是热和电的良导体.
(1)a呈深红棕色,a的元素在元素周期表中的位置为第四周期第VIIA族;
(2)写出d的元素原子的最外层电子排布式3s23p2;其元素原子核外中共有5种能量不同的电子;
(3)写出c的气态氢化物的水溶液与b的元素的最高价氧化物对应水化物反应的离子方程式H2S+2OH-=S 2-+H2O.
| 单质 | a | b | c | d | e |
| 沸点(℃) | 58.8 | 882.9 | 444.7 | 2 355 | 1 107 |
(2)写出d的元素原子的最外层电子排布式3s23p2;其元素原子核外中共有5种能量不同的电子;
(3)写出c的气态氢化物的水溶液与b的元素的最高价氧化物对应水化物反应的离子方程式H2S+2OH-=S 2-+H2O.
13.常温下,800ml pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、NO2-、I-、SO42-中的四种,且各离子的物质的量浓度均为0.1mol•L-1,现取该溶液进行有关实验,已知HNO2是一种不稳定的弱酸,实验结果如图所示:
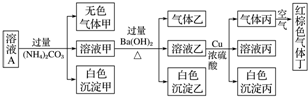
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 该溶液中一定有NO3-、Al3+、SO42-、Cl-四种离子 | |
| B. | 实验最多消耗Cu 1.92g,生成气体丙在标准状态下体积为448mL | |
| C. | 沉淀乙一定有BaCO3,可能有BaSO4 | |
| D. | 为确定原溶液中是否有Na+、K+,可通过焰色反应来确定 |
17.在化学学习与研究中经常采用“推理”的思维方式,但有时也会得出错误的结论.下列“推理”正确的是( )
| A. | 根据lmolO2和Mg完全反应获得4mol电子;可推出lmo1 O2和其他金属完全反应都获得4mol电子 | |
| B. | 相同pH值的H3PO4和H2SO4溶液,稀释相同倍数再分别测其pH值,若H3PO4溶液的pH小于H2SO4溶液,可推出元素的非金属性S>P | |
| C. | 根据Cl2+2KI=2KCl+I2反应中,氧化性:Cl2>I2;可推出SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑反应中,氧化性:C>Si | |
| D. | 向3%H2O2溶液中加0.1gMnO2粉末比加2滴1mol•L-1FeCl3溶液反应剧烈;根据此实验可推出MnO2的催化效果一定比FeCl3好 |
11.下列说法不正确的是( )
| A. | 甲烷与乙烯共1mol,完全燃烧后生成的H2O为2mol | |
| B. | 苯和苯乙烯都不能使酸性高锰酸钾溶液褪色 | |
| C. | 甲烷、苯都属于烃,都不存在同分异构体 | |
| D. | 丙烷和2-甲基丙烷的一氯代物均为两种 |
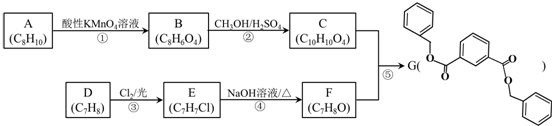
12.化合物X是一种医药中间体,其结构简式如图所示.下列有关化合物X的说法正确的是( )
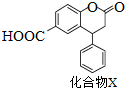

| A. | 分子中两个苯环一定处于同一平面 | |
| B. | 不能与饱和Na2CO3溶液反应 | |
| C. | 在酸性条件下水解,水解产物只有一种 | |
| D. | 1 mol化合物X最多能与2 molNaOH反应 |
 对物质性质的认识源于对其结构的了解.
对物质性质的认识源于对其结构的了解. .
.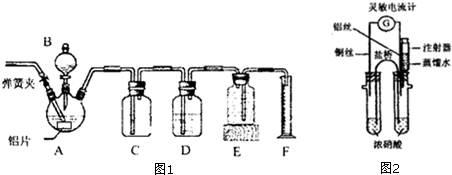
 .
.