题目内容
下列离子方程式书写正确的是( )
| A、铁粉与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B、盐酸中滴入碳酸钠溶液:CO32-+2H+=H2O+CO2↑ |
| C、盐酸中滴入氢氧化钠溶液:HCl+OH-=H2O+Cl- |
| D、稀硝酸滴在石灰石上:CO32-+2H+=H2O+CO2↑ |
考点:离子方程式的书写
专题:
分析:A.反应生成硫酸亚铁、氢气;
B.反应生成氯化钠、水、二氧化碳;
C.发生中和反应生成水和氯化钠;
D.石灰石的成分为碳酸钙,在离子反应中保留化学式.
B.反应生成氯化钠、水、二氧化碳;
C.发生中和反应生成水和氯化钠;
D.石灰石的成分为碳酸钙,在离子反应中保留化学式.
解答:
解:A.铁粉与稀硫酸反应的离子反应为Fe+2H+=Fe2++H2↑,故A错误;
B.盐酸中滴入碳酸钠溶液的离子反应为CO32-+2H+=H2O+CO2↑,故B正确;
C.盐酸中滴入氢氧化钠溶液的离子反应为H++OH-=H2O,故C错误;
D.稀硝酸滴在石灰石上的离子反应为CaCO3+2H+=H2O+CO2↑+Ca2+,故D错误;
故选B.
B.盐酸中滴入碳酸钠溶液的离子反应为CO32-+2H+=H2O+CO2↑,故B正确;
C.盐酸中滴入氢氧化钠溶液的离子反应为H++OH-=H2O,故C错误;
D.稀硝酸滴在石灰石上的离子反应为CaCO3+2H+=H2O+CO2↑+Ca2+,故D错误;
故选B.
点评:本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应及复分解反应的离子反应考查,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某种气体的摩尔质量为M g?mol-1,将标况下的该气体V L溶解在1000g水中,该气体不与水反应,所得溶液密度为ρ g?cm-3,则所得溶液中溶质的物质的量浓度为( ) mol?L-1.
A、
| ||
B、
| ||
C、
| ||
D、
|
设NA是阿伏加德罗常数的值,下列说法正确的是( )
| A、在32 g18O2中含有2NA个氧原子 |
| B、1molCl2与足量的铁反应转移的电子数与1mol铁与足量的Cl2反应转移的电子数相等 |
| C、某温度下纯水的pH=6,该温度下10LpH=11的NaOH溶液中含OH-的数目为NA |
| D、一定条件下,将1 mol N2与3 mol H2混合反应后,生成NH3分子的数目为2NA |
下列电离方程式正确的是( )
| A、CH3COOH=CH3COO-+H+ |
| B、H2SO4=2H++SO42- |
| C、Ba(OH)2=Ba2++(OH-)2 |
| D、KHCO3=K++H++CO32- |
下列说法中正确的是( )
| A、二氧化碳的水溶液能导电,所以二氧化碳是电解质 |
| B、1mol?L-1的硫酸钠溶液和1mol?L-1的氢氧化钠溶液,分别做导电性实验,两种溶液的导电性不同 |
| C、氢氧化铁胶体能导电,故氢氧化铁胶体是电解质 |
| D、在相同温度下,饱和溶液一定比不饱和溶液的导电性强 |
 如图是有关“水”部分知识的网络图(反应条件已省略),用化学用语填空:
如图是有关“水”部分知识的网络图(反应条件已省略),用化学用语填空: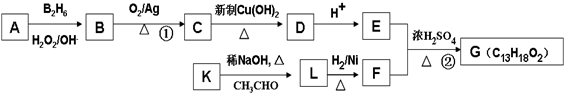

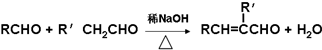
 ”结构的共有
”结构的共有 )互为同系物.
)互为同系物.
