题目内容
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol ②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g)?△H=-192.9kJ/mol根据上述反应,下列说法正确的是( )
A、 反应①中的能量变化如图所示 |
| B、可推知2H2(g)+O2(g)=2H2O(g)?△H=-483.8 kJ/mol |
| C、1 mol CH3OH充分燃烧放出的热量为192.9 kJ |
| D、CH3OH转变成H2的过程一定要吸收能量 |
考点:反应热和焓变
专题:
分析:A、反应①是吸热反应;图中是放热反应;
B、依据盖斯定律结合①②合并得到判断;
C、依据反应②甲醇反应生成二氧化碳和氢气的焓变是-192.9kJ/mol;而1 mol CH3OH充分燃烧生成二氧化碳和水放出的热量大于192.9 kJ;
D、根据①②反应可知,生成氢气的反应不一定是吸热反应;
B、依据盖斯定律结合①②合并得到判断;
C、依据反应②甲醇反应生成二氧化碳和氢气的焓变是-192.9kJ/mol;而1 mol CH3OH充分燃烧生成二氧化碳和水放出的热量大于192.9 kJ;
D、根据①②反应可知,生成氢气的反应不一定是吸热反应;
解答:
解:A、图中表示的是放热反应,而反应①是吸热反应,故A错误;
B、依据盖斯定律结合①②合并:②-①得到H2(g)+
O2(g)=H2O(g)△H=-241.9 kJ/mol;所以2H2(g)+O2(g)=2H2O(g)△H=-483.8 kJ/mol;故B正确;
C、反应②甲醇反应生成二氧化碳和氢气的焓变是-192.9kJ/mol;而1 mol CH3OH充分燃烧生成二氧化碳和水放出的热量大于192.9 kJ;故C错误;
D、CH3OH转变成H2的过程按照反应①是吸热反应,按照②反应是放热反应,所以不一定要吸收能量,故D错误;
故选B.
B、依据盖斯定律结合①②合并:②-①得到H2(g)+
| 1 |
| 2 |
C、反应②甲醇反应生成二氧化碳和氢气的焓变是-192.9kJ/mol;而1 mol CH3OH充分燃烧生成二氧化碳和水放出的热量大于192.9 kJ;故C错误;
D、CH3OH转变成H2的过程按照反应①是吸热反应,按照②反应是放热反应,所以不一定要吸收能量,故D错误;
故选B.
点评:本题考查了热化学方程式的书写和注意问题,利用热化学方程式进行分析判断反应的热效应,计算反应热量变化,盖斯定律的应用,题目难度中等.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
下列反应属于加成反应的是( )
| A、2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ | |||
B、 +HNO3 +HNO3
 +H2O +H2O | |||
C、CH3CH=CH2+Br2→ | |||
| D、CH3COOH+CH3CH2OH→CH3COOCH2CH3+H2O |
化学在生产和日常生活中有着重要的应用.下列说法错误的是( )
| A、半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 |
| B、葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 |
| C、淀粉、油脂、蛋白质都能水解,但水解产物不同 |
| D、纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污 |
下列叙述正确的是( )
| A、在醋酸溶液的PH=a,将此溶液稀释1倍后,溶液的PH=b,则a>b |
| B、在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的PH<7 |
| C、1.0×10-3盐酸的PH=3,1.0×10-8盐酸的PH=8 |
| D、若1mLPH=1的盐酸与100mLNaOH溶液混合后,溶液的PH=7则NaOH溶液的PH=11 |
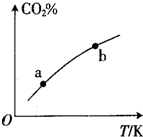 向某恒容密闭容器中充入一定量C02和H:,发生反应:CO2(g)+H2(g)?HCOOH(g)测得平衡体系中C02的百分含量(CQ%)与反应温度变化的关系如图所示.下列物理量 中,a点大于b点的是 ①正反应速率②逆反应速率③HCOOH(g)的浓度④对应温度时的平衡常数( )
向某恒容密闭容器中充入一定量C02和H:,发生反应:CO2(g)+H2(g)?HCOOH(g)测得平衡体系中C02的百分含量(CQ%)与反应温度变化的关系如图所示.下列物理量 中,a点大于b点的是 ①正反应速率②逆反应速率③HCOOH(g)的浓度④对应温度时的平衡常数( )| A、①② | B、①③ | C、②④ | D、③④ |
下列说法正确的是( )
A、根据反应Cu+H2SO4
| ||||
| B、电解含Pb(NO3)2和Cu(NO3)2的溶液,阴极上阳离子得电子次顺依次是Cu2+、H+、Pb2+ | ||||
| C、含amolNa2S的溶液最多能吸收2.5amol的二氧化硫气体 | ||||
| D、因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3═2NaIO3+Cl2不能发生 |
下列说法正确的是( )
| A、碘化铵和氯化铵受热分解过程中破坏和形成的化学键类型完全相同 |
| B、反应N2H4(l)=N2(g)+2H2(g)是一个△S>0的反应 |
| C、1 mol FeCl3完全水解得到的Fe(OH)3胶体中胶粒数目为NA(NA为阿伏加德罗常数) |
| D、HClO是弱酸,所以NaClO是弱电解质 |
下列物质的电子式书写正确的是 ( )
A、 |
B、 |
C、 |
D、 |
实验室使用pH传感器来测定Na2CO3和NaHCO3混合物中NaHCO3的含量.称取1.59g 样品,溶于水配成250.00ml溶液,取出该溶液25.00ml用 0.1mol?L-1 盐酸进行滴定,得到如下曲线.以下说法或操作正确的是( )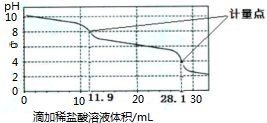

| A、上一个计量点前发生反应的离子方程式为HCO3-+H+═H2O+CO2↑ |
| B、下一个计量点溶液中存在大量的阴离子是Cl-、HCO3- |
| C、此样品n(NaHCO3)=(28.1-2×11.9)×10-3 mol |
| D、使用该方法测定Na2CO3和NaOH混合溶液中的氢氧化钠含量,将会得到1个计量点 |