题目内容
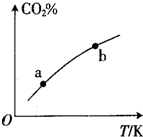 向某恒容密闭容器中充入一定量C02和H:,发生反应:CO2(g)+H2(g)?HCOOH(g)测得平衡体系中C02的百分含量(CQ%)与反应温度变化的关系如图所示.下列物理量 中,a点大于b点的是 ①正反应速率②逆反应速率③HCOOH(g)的浓度④对应温度时的平衡常数( )
向某恒容密闭容器中充入一定量C02和H:,发生反应:CO2(g)+H2(g)?HCOOH(g)测得平衡体系中C02的百分含量(CQ%)与反应温度变化的关系如图所示.下列物理量 中,a点大于b点的是 ①正反应速率②逆反应速率③HCOOH(g)的浓度④对应温度时的平衡常数( )| A、①② | B、①③ | C、②④ | D、③④ |
考点:体积百分含量随温度、压强变化曲线,化学平衡常数的含义
专题:化学平衡专题
分析:根据图象可知,可逆反应CO2(g)+H2(g)?HCOOH(g)随着温度升高,二氧化碳含量增大,说明正反应为放热反应;温度越高,反应速率越大,则a点的正逆反应速率都小于b点;HCOOH(g)为生成物,二氧化碳、氢气为反应物,则二氧化碳百分含量越大,则氢气含量越大、甲酸含量越小,则a点甲酸的浓度大于b点、a点氢气的浓度大于b点,由于温度改变反应向正方向移动时,平衡常数增大,据此进行解答.
解答:
解:①温度升高,反应速率增大,a点温度小于b,则a点的正反应速率一定小于b,故错误;
②b点温度大于a点,则正逆反应速率a点小于b点,故错误;
③甲酸为生成物,二氧化碳为反应物,则二氧化碳百分含量越大,甲酸浓度越小,b点二氧化碳百分含量大于a点,则a点甲酸的浓度大于b点,故正确;
④温度升高,平衡逆向移动,平衡常数减小,a点大于b点的,故正确;
综上,①②错误,③④正确,
故选D.
②b点温度大于a点,则正逆反应速率a点小于b点,故错误;
③甲酸为生成物,二氧化碳为反应物,则二氧化碳百分含量越大,甲酸浓度越小,b点二氧化碳百分含量大于a点,则a点甲酸的浓度大于b点,故正确;
④温度升高,平衡逆向移动,平衡常数减小,a点大于b点的,故正确;
综上,①②错误,③④正确,
故选D.
点评:本题考查了百分含量随温度变化的曲线、可逆反应的影响因素,题目难度不大,注意掌握外界条件对化学平衡的影响,正确分析图象中曲线变化为解答本题的关键,试题培养了学生分析、理解图象信息的能力.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
下列说法正确的是( )
| A、少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |
| B、将含硫酸的废液倒入水槽,用水冲入下水道 |
| C、用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 |
| D、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶支管口处 |
下列有关新闻事件的叙述正确的是( )
| A、在结冰的路面上撒盐,是利用盐与水发生化学反应放出大量热量,促使冰雪融化 |
| B、我国决定推广使用车用乙醇汽油,乙醇汽油是一种新型的化合物,属于可再生能源 |
| C、利用可降解的生物质材料“玉米塑料”(主要成分为聚乳酸)替代一次性饭盒,可防止产生白色污染 |
| D、氮化硅陶瓷可用于制造新型柴油发动机是因为氮化硅陶瓷具有较大的硬度 |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol ②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g)?△H=-192.9kJ/mol根据上述反应,下列说法正确的是( )
A、 反应①中的能量变化如图所示 |
| B、可推知2H2(g)+O2(g)=2H2O(g)?△H=-483.8 kJ/mol |
| C、1 mol CH3OH充分燃烧放出的热量为192.9 kJ |
| D、CH3OH转变成H2的过程一定要吸收能量 |
原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,X、Z的最外层电子数之和与Y、W的最外层电子数之和相等.甲的化学式为YX3,是一种刺激性气味的气体,乙的化学式为YZ3,丙是由X、Y、Z组成的盐.下列说法正确的是( )
| A、原子半径:W>Y>Z,而离子半径:Z>Y>W |
| B、甲沸点远高于乙,可能是甲分子间存在氢键所致 |
| C、测得丙的水溶液呈酸性,则溶液中丙盐阳离子浓度大于酸根离子浓度 |
| D、W的氯化物水溶液中通入YX3至过量,现象是先有白色沉淀,后逐渐溶解 |
已知反应①:CO(g)+CuO(s)?CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)?Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)?CO2(g)+H2(g)的平衡常数为K.则下列说法正确的是( )
A、反应①的平衡常数K1=
| ||
B、反应③的平衡常数K=
| ||
| C、对于反应③,恒容时,温度升高,H2浓度减小,则该反应为吸热反应 | ||
| D、对于反应③,恒温恒容下,增大压强,H2浓度一定增大 |
 温室气体二氧化碳减排的一种方法是:从燃煤电厂或天然气电厂排放气中回收CO2,再与CH4热解炉产生的H2厂生成CH3OH:CO2(g)+3H2(g)
温室气体二氧化碳减排的一种方法是:从燃煤电厂或天然气电厂排放气中回收CO2,再与CH4热解炉产生的H2厂生成CH3OH:CO2(g)+3H2(g)
| ||
| A、在前3分钟内v(H2)=10molL-1min-1 |
| B、在3分钟时CO2和CH3OH浓度相等,反应达到平衡 |
| C、在前15分钟内平衡常数K随CO2减少而逐渐减小 |
| D、在前15分钟时向设备中充入CO2和H2各10mol以提高H2转化率 |