题目内容
16.某无色溶液中,先加入足量稀盐酸,无任何变化,再加入BaCl2(aq),产生白色沉淀,则下列说法中正确的是( )| A. | 无色溶液中一定含有SO42- | |
| B. | 无色溶液中一定含有Ag+ | |
| C. | 无色溶液中一定同时含有SO42-和Ag+ | |
| D. | 无色溶液中可能含有Ag+和SO42-中的一种或两种 |
分析 先加入足量稀盐酸,无任何变化,可排除干扰离子,再加入BaCl2(aq),产生白色沉淀,白色沉淀为硫酸钡,以此来解答.
解答 解:先加入足量稀盐酸,无任何变化,则一定不含Ag+,再加入BaCl2(aq),产生白色沉淀,白色沉淀为硫酸钡,则一定含SO42-,只有A符合,
故选A.
点评 本题考查离子的检验,为高频考点,把握离子检验的试剂、现象和结论为解答的关键,侧重分析与应用能力的考查,注意离子检验时排除干扰离子,题目难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
17.下列过程一定涉及氧化还原反应的是( )
| A. | 萃取 | B. | 电解 | C. | 净水 | D. | 分馏 |
4.下列关于电解质的说法正确的是( )
| A. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 | |
| B. | 水溶液中导电能力差的电解质一定是弱电解质 | |
| C. | 强电解质在稀的水溶液中全部以离子的形态存在 | |
| D. | 强电解质都是离子化合物,而弱电解质都是共价化合物 |
11.已知在常温常压下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
| A. | 2H2 (g)+O2(g)=2H2O(l);△H=-484kJ•mol-1 | |
| B. | 2H2 (g)+O2(g)=2H2O(g);△H=+484kJ•mol-1 | |
| C. | H2 (g)+$\frac{1}{2}$O2(g)=H2O(g);△H=+242kJ•mol-1 | |
| D. | H2O(g)=H2(g)+$\frac{1}{2}$O2(g);△H=+242kJ•mol-1 |
1.下列关于离子共存或离子反应的说法正确的是( )
| A. | 某无色溶液中可能大量存在H+、Cl-、MnO4- | |
| B. | pH=2的溶液中可能大量存在Na+、NH4+、SiO32- | |
| C. | 冷的氢氧化钠溶液中通入氯气:Cl2+2OH-═ClO-+Cl-+H2O | |
| D. | 稀硫酸和氢氧化钡溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
8.下列实验操作能达到实验目的是( )
| A. | 向容量瓶中注入液体时,奖容量瓶的玻璃塞倒置在桌面上防止被污染 | |
| B. | 鉴别NO2和溴蒸汽时,将二者分别通到湿润的KI-淀粉试纸上观察颜色变化 | |
| C. | 将甲烷和乙烯的混合气体通入足量溴水,以除去乙烯 | |
| D. | 将洗净的滴定管放到烘箱中烘干,以加快干燥速度 |
5. 最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )
最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )
 最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )
最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )| A. | 放电时,负极发生:2AlCl4--e-=Al2Cl3-+Cl- | |
| B. | 充电时,泡沫石墨极与外电源的负极相连 | |
| C. | 放电时,电路中每流过3mol电子,正极减少27g | |
| D. | 充电时,阴极发生:4Al2Cl3-+3e-=Al+7AlCl4- |
6.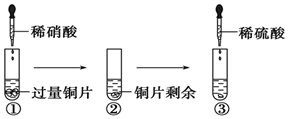 某化学兴趣小组进行有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示.下列有关说法正确的是
某化学兴趣小组进行有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示.下列有关说法正确的是
( )
 某化学兴趣小组进行有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示.下列有关说法正确的是
某化学兴趣小组进行有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示.下列有关说法正确的是( )
| A. | ①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO2 | |
| B. | ③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O | |
| C. | ③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强 | |
| D. | 由上述实验可知:Cu在常温下既可与稀硝酸反应,也可与稀硫酸反应 |