题目内容
6.下列氧化还原反应中电子转移数目及方向都正确的是( )| A. |  | B. |  | ||
| C. |  | D. |  |
分析 A.Cl得到电子,O失去电子,该反应转移12e-;
B.Fe得到电子,I失去电子,该反应转移2e-;
C.F得到电子,O失去电子,该反应转移4e-;
D.Br得到电子,S失去电子,该反应转移2e-,以此来解答.
解答 解:A.Cl得到电子,O失去电子,该反应转移12e-,图中转移电子数目不合理,故A错误;
B.Fe得到电子,I失去电子,该反应转移2e-,则 合理,故B正确;
合理,故B正确;
C.F得到电子,O失去电子,该反应转移4e-,图中箭头的方向不合理,故C错误;
D.Br得到电子,S失去电子,该反应转移2e-,图中箭头的方向不合理,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化、电子转移表示方法为解答的关键,侧重分析与应用能力的考查,注意电子转移数目及箭头方向,题目难度不大.

练习册系列答案
相关题目
7.下列说法不正确的是( )
| A. | 一定温度下,某密闭容器发生如下反应:CaCO3(s)?CaO(s)+CO2(g),达到平衡后,将容器体积缩小为原来的一半,当体系再次达到化学平衡时,CO2的物质的量浓度不变 | |
| B. | 已知某温度下,Kw=l×10-13,若将pH=8的NaOH溶液与pH=5的H2SO4溶液混合,保持温度不变,欲使混合溶液pH=7,则NaOH溶液与H2SO4溶液的体积比为11:9 | |
| C. | 已知:KSP(AgCl)=1.8×10-10,Ksp(Ag2CrO2)=2.0×10-12,将0.001 mol•L-1的AgNO3溶液滴入0.001mol•L-1 KCl和0.001 rnol•L-1IK2CrO4的混合溶液中,先产生AgCl沉淀 | |
| D. | 已知25℃时,有关弱酸的电离平衡常数:HCNKa=4.9×10-10:H2CO3,Ka1=4.3×10-7,Ka2=5.6×10-11.则CO2通入NaCN溶液中反应的化学方程式为:2NaCN+H2O+CO2═2HCN+Na2CO3 |
8.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
请回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)该反应为吸热反应(选填吸热、放热).
(3)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为900℃
(4)900℃时,在1L固定的密闭容器中,加入2mol CO2和1mol H2,反应进行一段时间后,测得CO的浓度为0.5mol/L,则此时该反应是否达到平衡状态否(填“是”或“否”),此时v(正)大于v(逆)(填“大于”“小于”或“等于”),达到平衡时CO2的转化率为33.3%.
(5)化学平衡移动原理同样也适用于溶液中的平衡,已知在氨水中存在下列平衡:
NH3+H2O?NH3•H2O?NH4++OH-
①向氨水中加入MgCl2固体时,平衡向右移动(填“左”或“右”),溶液中OH-的浓度B(填序号,下同),NH4+离子的浓度A.
A.变大B.变小C.不变
②向浓氨水中加入少量的NaOH固体,上述平衡向左移动(填“左”或“右”),溶液中OH-的浓度A(填序号,下同),NH4+离子的浓度B.
A.变大B.变小C.不变.
| t/℃ | 700 | 800 | 900 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)该反应为吸热反应(选填吸热、放热).
(3)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为900℃
(4)900℃时,在1L固定的密闭容器中,加入2mol CO2和1mol H2,反应进行一段时间后,测得CO的浓度为0.5mol/L,则此时该反应是否达到平衡状态否(填“是”或“否”),此时v(正)大于v(逆)(填“大于”“小于”或“等于”),达到平衡时CO2的转化率为33.3%.
(5)化学平衡移动原理同样也适用于溶液中的平衡,已知在氨水中存在下列平衡:
NH3+H2O?NH3•H2O?NH4++OH-
①向氨水中加入MgCl2固体时,平衡向右移动(填“左”或“右”),溶液中OH-的浓度B(填序号,下同),NH4+离子的浓度A.
A.变大B.变小C.不变
②向浓氨水中加入少量的NaOH固体,上述平衡向左移动(填“左”或“右”),溶液中OH-的浓度A(填序号,下同),NH4+离子的浓度B.
A.变大B.变小C.不变.
14. 【化学-选修2化学与技术】
【化学-选修2化学与技术】
许多含碳、氢物质是重要的化工原料.
(1)某新型储氢合金(化学式为Mg17Al12)的储氢原理为Mg17Al12+17H2═17MgH2+12Al,此变化中还原产物是MgH2(填化学式).
(2)草酸的钙盐、钡盐、镁盐难溶于水.已知C2O3是无色无味气体,可溶于水生成草酸(H2C2O4),写出它溶于足量Ba(OH)2溶液发生反应的化学方程式C2O3+Ba(OH)2=BaC2O4↓+H2O.
(3)已知:几个热化学方程式如下:
①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-198kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2
③CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H3=-846.3kJ•mol-1
写出甲烷与水蒸气在高温下制备合成气(CO,H2)的热化学方程式CH4(g)+H2O(g)?CO(g)+3H2(g)△H=30.7KJ/mol.
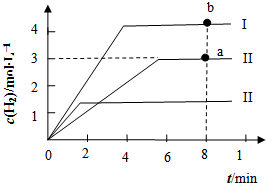
(4)向2L恒容密闭容器中充入3mol CH4(g)、4mol H2O(g),发生反应制备CO、H2,测得温度为t℃时,容器内H2的物质的量浓度(mol•L-1)随时间的变化如图中II曲线所示.图中I、III分别表示相对于II仅改变反应条件后,c(H2)随时间的变化.
①若曲线I仅代表改变一种条件后的情况,则改变的条件可能是升温;a、b两点用CO浓度变化表示的净反应速率关系为a<b;
②曲线II对应反应的平衡常数K为54.该温度下,若将等物质的量浓度的CH4(g)、H2O(g)、CO(g)、H2(g)混合充入该容器中,则开始进行方向是无法确定(填:向左、向右、平衡或无法确定).
③曲线III相对于曲线II改变的条件是B.
A.降低温度 B.使用催化剂、降低温度 C.加压.
 【化学-选修2化学与技术】
【化学-选修2化学与技术】许多含碳、氢物质是重要的化工原料.
(1)某新型储氢合金(化学式为Mg17Al12)的储氢原理为Mg17Al12+17H2═17MgH2+12Al,此变化中还原产物是MgH2(填化学式).
(2)草酸的钙盐、钡盐、镁盐难溶于水.已知C2O3是无色无味气体,可溶于水生成草酸(H2C2O4),写出它溶于足量Ba(OH)2溶液发生反应的化学方程式C2O3+Ba(OH)2=BaC2O4↓+H2O.
(3)已知:几个热化学方程式如下:
①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-198kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2
③CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H3=-846.3kJ•mol-1
| 化学键 | C≡O | O═O | C═O(CO2中) |
| 键能(kJ•mol-1) | 958.5 | 497 | 745 |
(4)向2L恒容密闭容器中充入3mol CH4(g)、4mol H2O(g),发生反应制备CO、H2,测得温度为t℃时,容器内H2的物质的量浓度(mol•L-1)随时间的变化如图中II曲线所示.图中I、III分别表示相对于II仅改变反应条件后,c(H2)随时间的变化.
①若曲线I仅代表改变一种条件后的情况,则改变的条件可能是升温;a、b两点用CO浓度变化表示的净反应速率关系为a<b;
②曲线II对应反应的平衡常数K为54.该温度下,若将等物质的量浓度的CH4(g)、H2O(g)、CO(g)、H2(g)混合充入该容器中,则开始进行方向是无法确定(填:向左、向右、平衡或无法确定).
③曲线III相对于曲线II改变的条件是B.
A.降低温度 B.使用催化剂、降低温度 C.加压.
1. (1)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一.
(1)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一.
已知:CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ•mol-1K1
2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1K2
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1K3
(1)则CO2和氢气合成CH3OCH3(g)的热化学方程式为2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)△H=-122.5kJ/mol;
该反应的平衡常数K=$\frac{{{K}_{1}}^{2}•{K}_{2}}{{{K}_{3}}^{2}}$(用K1、K2、K3表示)
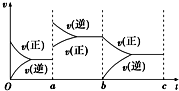
(2)如图表示在密闭容器中反应:2SO2+O2?2SO3△H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a→b过程中改变的条件可能是升高温度;b→c过程中改变的条件可能是将SO3从体系中分离出来.
(3)在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)═M(g)+N(g),所得实验数据如表:
则实验③中达到平衡时X的转化率为60%; 实验④中达到平衡时b<(填“>”“<”或“=”)0.060.
 (1)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一.
(1)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一.已知:CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ•mol-1K1
2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1K2
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1K3
(1)则CO2和氢气合成CH3OCH3(g)的热化学方程式为2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)△H=-122.5kJ/mol;
该反应的平衡常数K=$\frac{{{K}_{1}}^{2}•{K}_{2}}{{{K}_{3}}^{2}}$(用K1、K2、K3表示)
(2)如图表示在密闭容器中反应:2SO2+O2?2SO3△H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a→b过程中改变的条件可能是升高温度;b→c过程中改变的条件可能是将SO3从体系中分离出来.
(3)在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)═M(g)+N(g),所得实验数据如表:
| 实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
11.已知在常温常压下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
| A. | 2H2 (g)+O2(g)=2H2O(l);△H=-484kJ•mol-1 | |
| B. | 2H2 (g)+O2(g)=2H2O(g);△H=+484kJ•mol-1 | |
| C. | H2 (g)+$\frac{1}{2}$O2(g)=H2O(g);△H=+242kJ•mol-1 | |
| D. | H2O(g)=H2(g)+$\frac{1}{2}$O2(g);△H=+242kJ•mol-1 |
16.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,44g丙烷含有共价键的数目为10NA | |
| B. | 1 L 1 mol•L-1的Na2CO3溶液中含有氧原子的数目为3NA | |
| C. | 常温常压下,11.2L由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 标准状况下,6.72 L NO2溶于足量的水中,转移电子的数目为0.3NA |
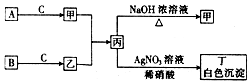 已知A、B、C为中学常见的气体单质,甲、乙、丙、丁为常见的化合物,甲的水溶液呈碱性.它们之间有如图所示的转化关系(部分产物及反应条件已略去)
已知A、B、C为中学常见的气体单质,甲、乙、丙、丁为常见的化合物,甲的水溶液呈碱性.它们之间有如图所示的转化关系(部分产物及反应条件已略去)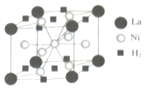 钒和镍及其化合物是重要的催化剂和合金材料.请回答:
钒和镍及其化合物是重要的催化剂和合金材料.请回答: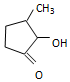 可形成配合物.
可形成配合物. 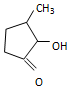 中,三种非金属原子的第一电离能由大到小的顺序为O>C>H(用元素符号表示);C原子的杂化轨道类型为sp3和sp2.
中,三种非金属原子的第一电离能由大到小的顺序为O>C>H(用元素符号表示);C原子的杂化轨道类型为sp3和sp2.