题目内容
9.已知铁的化合物之间有如下转化关系:Fe2+$?_{④}^{①}$Fe3+$?_{③}^{②}$FeO42-(高铁酸根离子)
请回答下列有关问题:
(1)Fe与过量稀盐酸反应可以制取FeCl2,若用反应所得的酸性溶液,实现上述①的转化,要求产物纯净,可选用的试剂是c(选填序号);
a.KMnO4 b.HNO3 c.H2O2
(2)硫酸铁可用于电化浸出黄铜矿精矿工艺,精矿在阳极浸出的反应比较复杂,其中有一主要反应:
CuFeS2+4Fe3+═Cu2++5Fe2++2S(CuFeS2中S为-2价)则下列说法正确的是c(选填序号);
a.从物质分类的角度看,黄铜矿属于合金
b.Cu2+和S是氧化产物
c.当转移1mol电子时,46gCuFeS2参加反应
d.反应中,CuFeS2既作氧化剂又作还原剂
(3)在FeCl3、CuCl2混合溶液中,加入一定量的铁屑,反应完全后将固体滤出.
①若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,一定不含的阳离子是Fe3+.
②若滤出的固体中含有铁和铜,则溶液中一定不含的阳离子是Cu2+和Fe3+.
(4)高酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,和水发生水解反应生成Fe(OH)3胶体等物质,写出FeO42-和H2O反应的离子方程式4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-.高酸钾作为水处理剂发挥的作用是净水、消毒.(用简洁的名词描述即可)
分析 (1)要使产物纯净,必须物质间发生反应后,没有杂质生成,根据物质的性质及是否引进杂质确定选项;
(2)根据合金的定义、化合价的升降、发生反应的物质与转移电子之间的关系判断;
(3)在FeCl3、CuCl2混合溶液中,加入一定量的铁屑,则铁能与氯化铁和氯化铜溶液反应,反应先后顺序是:2FeCl3+Fe═3FeCl2,CuCl2+Fe═FeCl2+Cu,据此回答;
(4)高铁酸钾( K2FeO4)中Fe的化合价是+6价,具有强氧化性,能杀菌消毒,FeO42-和H2O发生水解反应生成Fe(OH)3胶体,能吸附水中杂质.
解答 解:(1)要使产物纯净,必须物质间发生反应后,没有杂质生成;
a、KMnO4有氧化性,能氧化二价铁离子生成三价铁离子,但同时有锰离子生成,所以有杂质生成,故a错误;
b、硝酸能氧化二价铁离子生成三价铁离子,但溶液中还有杂质硝酸根离子,故b错误;
c、双氧水能氧化二价铁离子生成三价铁离子,同时有水生成,水是原溶液的成分,所以不是杂质,故c正确;
故答案为:c;
(2)a、合金是由两种或两种以上的金属与非金属经一定方法所合成的具有金属特性的物质,所以黄铜矿不是合金,故a错误;
b、CuFeS2+4Fe3+═Cu2++5Fe2++2S反应中Cu化合价不变,所以Cu2+不是氧化产物,故b错误;
c、CuFeS2+4Fe3+=Cu2++5Fe2++2S 转移电子4
184g 4mol
46g 1mol
故c正确;
d、CuFeS2中只有S元素的化合价只有升高,其他元素的化合价不变,所以CuFeS2只作还原剂,故d错误;
故选c;
(3)在FeCl3、CuCl2混合溶液中,加入一定量的铁屑,反应先后顺序是:2FeCl3+Fe═3FeCl2,CuCl2+Fe═FeCl2+Cu.
①若滤出的固体只有铜,则溶液中一定含有的阳离子是Fe2+,也可能含Cu2+,一定不含Fe3+,故答案为:Fe2+;Fe3+;
②若滤出的固体中含有铁和铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+和Fe3+,故答案为:Cu2+和Fe3+;
(4)高铁酸钾( K2FeO4)中Fe的化合价是+6价,具有强氧化性,能杀菌消毒,FeO42-和H2O发生水解反应生成Fe(OH)3胶体,能吸附水中杂质,离子方程式为:4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,所以高铁酸钾作为水处理剂发挥的作用是净水、消毒,故答案为:4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-;净水;消毒.
点评 本题考查了铁盐和亚铁盐的相互转化,题目难度中等,依据金属活动性顺序以及离子的氧化性顺序是解题的关键,离子方程式的配平是本题的难点.

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案Y极:4H2O+2O2+8e-═8OH-
关于此燃料电池的说法,错误的是( )
| A. | X极为负极,Y极为正极 | |
| B. | 在标准状况下通入5.6LO2完全反应,则有0.5mol电子发生转移 | |
| C. | 工作一段时间后,KOH的物质的量减小 | |
| D. | 该电池工作时甲烷一极附近溶液pH下降 |
| A. | 1mol O的质量是16 g/mol | B. | Na+的摩尔质量是23 g/mol | ||
| C. | CO2的质量是44 g/mol | D. | 氢的摩尔质量是2 g/mol |
| A. | 溴水 | B. | 酸性高锰酸钾溶液 | ||
| C. | 溴化钠溶液 | D. | 浓硫酸 |
| A. | H+、Na+、CO32- | B. | K+、NO3-、Cl- | ||
| C. | Na+、Fe3+、OH- | D. | Ba2+、SO42-、HCO3- |
①甲同学将用剩的钠或钾应及时放回原试剂瓶;
②乙同学用灯帽盖灭酒精灯;
③丙同学给容量为30mL的试管中加入20mL液体加热;
④丁同学用酒精萃取碘水中的碘;
⑤戊同学将浓硫酸倒入装有适量水的量筒中稀释;
⑥己同学配制NaOH溶液时,将NaOH固体在烧杯中溶解后,立即注入容量瓶中.
| A. | 只有②③ | B. | ①② | C. | 只有②③④ | D. | 全部正确 |
 如图两个装置中,液体体积均为200ml,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol电子,若不考虑溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200ml,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol电子,若不考虑溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积①=② | |
| B. | 电极上析出固体质量①<② | |
| C. | 溶液的pH变化:①减小②增大 | |
| D. | 电极反应式:①中阳极Cu2++2e-=Cu,②中负极Zn-2e-=Zn2+ |
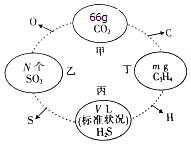 如图,两相邻圆圈内物质间含有相同的某一原子,且该原子的物质的量相同.(设NA为阿伏伽德罗常数的值)
如图,两相邻圆圈内物质间含有相同的某一原子,且该原子的物质的量相同.(设NA为阿伏伽德罗常数的值)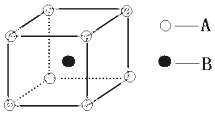 根据离子晶体的晶胞结构,判断下列离子晶体的化学式:AB(A表示阳离子,B表示阴离子).
根据离子晶体的晶胞结构,判断下列离子晶体的化学式:AB(A表示阳离子,B表示阴离子).